परमाणु किसी पदार्थ (Substance) या तत्त्व (Element) का वह सूक्ष्मतम कण (Particle) है जो स्वतंत्र अवस्था में नहीं रह सकता परन्तु सभी प्रकार की रासायनिक अभिक्रियाओं (Chemical Reactions) में भाग लेता है अर्थात् इसका रासायनिक अस्तित्व (Chemical Existence) होता है।
पहले परमाणु को सूक्ष्मतम अविभाज्य कण माना जाता था परन्तु आधुनिक प्रयोगों द्वारा इस बात की पुष्टि हो चुकी है कि इसके अंदर भी बहुत सारे सूक्ष्म कण (इलेक्ट्रॉन, प्रोटॉन, न्यूट्रॉन, पॉजीट्रॉन, न्यूट्रिनो इत्यादि) विद्यमान होते हैं अर्थात् परमाणु भी विभाज्य है। किसी तत्त्व के सभी परमाणु आपस में समान होते हैं परन्तु अलग- अलग तत्वों के परमाणु भी अलग-अलग तरह के होते हैं।
ज्ञातव्य है कि कुछ तत्वों जैसे निष्क्रिय गैसों (हीलियम, नियान, आर्गन व क्रिप्टॉन आदि) के परमाणु स्वतंत्र अवस्था में भी रह सकते हैं क्योंकि ये परस्पर तथा अन्य तत्वों के परमाणुओं से संयोग नहीं करते।
➤ अणु (Molecule)
अणु किसी पदार्थ (तत्व अथवा यौगिक) का वह सूक्ष्मतम (Smallest) कण (Particle) है जो स्वतंत्र अवस्था में रह सकता है, परन्तु रासायनिक अभिक्रियाओं में भाग नहीं लेता। यह पदार्थ के सभी गुणों का प्रतिनिधित्व करता है। इसका निर्माण परमाणुओं से होता है। ज्ञातव्य है कि तत्त्वों के एक अणु में एक या अधिक समान प्रकार के परमाणु तथा यौगिकों (Compounds) के एक अणु में दो या अधिक अलग-अलग तरह के परमाणु होते हैं।
परमाणु संरचना (Atomic Structure)
परमाणु मुख्यतः तीन मौलिक कणों से मिलकर बना होता है जिन्हें इलेक्ट्रॉन, प्रोटॉन व न्यूट्रॉन कहते हैं। परमाणु के बीच में एक नाभिक (Nucleus) होता है जिसमें धनावेशित प्रोटॉन व आवेश रहित न्यूट्रॉन पाये जाते हैं। नाभिक के बाहर ऋणावेशित इलेक्ट्रॉन होते हैं जो नाभिक के चारों ओर विभिन्न कक्षकों (Orbits) में चक्कर लगाते रहते हैं। इलेक्ट्रॉनों व प्रोटॉनों की संख्या बराबर होती है, जिन पर विपरीत प्रकृति का परन्तु समान मात्रा में आवेश पाया जाता है। फलतः संपूर्ण परमाणु विद्युत उदासीन होता है। ज्ञातव्य है कि उक्त तीनों के अलावा और भी बहुत से (30 से अधिक) मौलिक कणों की खोज हो चुकी है और आगे भी ऐसी खोज जारी है। इस प्रकार हम कह सकते हैं कि अनन्त ब्रह्माण्ड की तरह सूक्ष्म परमाणु भी अपने अन्दर असंख्य रहस्य समेटे हुए है।
यहाँ कुछ महत्वपूर्ण मौलिक कणों का परिचय निम्नवत है। यथा-
(i) इलेक्ट्रॉन (Electron)- परमाणु मूल कणों में सर्वप्रथम इलेक्ट्रॉन (Electron) की खोज सन् 1897 ई० में जे.जे. थामसन द्वारा किया गया।* नाभिक के बाहर नाभिक की परिक्रमा करने वाले इन कणों पर 1.6 × 10-19 कूलाम का ऋण आवेश होता है। * एक इलेक्ट्रॉन का द्रव्यमान 9.1 × 10-31 किग्रा होता है।* यह एक स्थाई मूल कण है जिसका विभिन्न रासायनिक अभिक्रियाओं में सर्वाधिक महत्व होता है।*
(ii) प्रोटॉन (Proton)- प्रोटॉन नाभिक में पाया जाने वाला स्थाई कण है जिस पर 1.6 × 10-19 कूलाम का धनावेश होता है।’ इसका द्रव्यमान (mass) 1.67 × 10-27 किग्रा. होता है। इसकी खोज 1886 ई. में गोल्डस्टीन ने की परन्तु इस कण का नाम ‘प्रोटॉन’ रदरफोर्ड (1919) ने दिया। * इसका उपयोग तत्वान्तरण (trans- mutation of elements) में होता है।*
(iii) न्यूट्रॉन (Neutron)- यह परमाणु के नाभिक में प्राप्य एक आवेश रहित मूल कण है। इसका द्रव्यमान प्रोटॉन के द्रव्यमान के बराबर होता है।* इसकी खोज सन् 1932 में जेम्स चैडविक ने की थी। * इलेक्ट्रॉन, प्रोटॉन के विपरीत यह एक अस्थाई कण होता है जिसका अर्ध आयु 17 मिनट होती है। * आवेश रहित होने के कारण इसका उपयोग नाभिकीय विखण्डन (nuclear fission) में किया जाता है। इसके अलावा चिकित्सा विज्ञान व जीव विज्ञान में भी इसका उपयोग बहुतायत हो रहा है।
(iv) पॉजीट्रॉन (Positron)- इसकी खोज 1932 में एण्डरसन ने की थी। यह एक अस्थाई, धनावेशित मूल कण है जिसका द्रव्यमान व आवेश की मात्रा इलेक्ट्रॉन के बराबर होती है। इसीलिए इसे एण्टीइलेक्ट्रॉन कण (Anti-Electron Particle) भी कहते हैं।* इसका चक्रण (Spin) भी इलेक्ट्रॉन के विपरीत होता है। एक पॉजीट्रॉन व एक इलेक्ट्रॉन मिलकर दो गामा फोटॉन (y-photon) का निर्माण करते हैं।*
(v) न्यूट्रिनो (Neutrino)- इसकी खोज 1930 में पाउली (Pauli) ने की थी। यह द्रव्यमान व आवेश रहित मूल कण है।* एण्टीन्यूट्रिनो इसका प्रति कण (Anti Particle) है। दोनों का चक्रण (Spin) एक दूसरे के विपरीत होता है।
(vi) पाई-मेसॉन (Pi (π) Meson)- इसकी खोज 1935 ई० में युकावा ने की थी। यह एक अस्थाई मूल कण है जो तीन प्रकार का होता है-धनात्मक पाई मेसॉन (π+), ऋणात्मक पाई मेसॉन (π–) व उदासीन पाई मेसॉन (π०)। इसका द्रव्यमान इलेक्ट्रॉन के द्रव्यमान का 270 गुना होता है। यह 10-8 सेकेण्ड के लिए बनता है फिर नष्ट हो जाता है।
(vi) फोटॉन (Photon)- ये ऊर्जा के छोटे-छोटे बण्डल (Packets) होते हैं जो प्रकाश की चाल से गति (Motion) करते हैं। इनका विराम द्रव्यमान (Rest mass) शून्य होता है। सभी प्रकार की विद्युत चुम्बकीय तरंगों का निर्माण फोटॉनों के गति करने से ही होता है।* ये परमाणु के भाग नहीं हैं परन्तु विभिन्न नाभिकीय क्रियाओं, यथा- नाभिकीय विघटन व विखण्डन के समय निकलते हैं।
नाभिक (Neucleus)
यह परमाणु का घनीभूत (Highly Danse), केन्द्रीय भाग होता है जिसमें परमाणु का समस्त धनावेश (प्रोटॉनों के कारण) व लगभग संपूर्ण द्रव्यमान (न्यूट्रॉनों व प्रोटॉनों के कारण) निहित होता है। नाभिक की त्रिज्या 10-14 मीटर की कोटि की होती है। (जबकि परमाणु की त्रिज्या 10-10 मीटर की कोटि की होती है।) नाभिक का घनत्व 1017 किग्रा/घनमीटर की कोटि का होता है जोकि परमाणु के शेष भाग के घनत्व का 1012 गुना अधिक होता है। नाभिक की खोज रदरफोर्ड ने की जिसके कारण उन्हें नाभिकीय भौतिकी का जनक कहा जाता है।* इसके लिए उन्हें 1908 ई० में रसायन का नोबेल पुरस्कार भी दिया गया था।
नाभिकीय बल (Nuclear Force)
नाभिक में उपस्थित कणों को बाँधे रखने व नाभिक को स्थायित्व प्रदान करने वाले बल को नाभिकीय बल कहते हैं। ज्ञातव्य है कि प्रोटॉनों के मध्य समान प्रकृति का धनात्मक आवेश होने के कारण प्रतिकर्षण बल कार्य करता है, फिर भी सभी प्रोटॉन नाभिक से दृढ़ता पूर्वक जुड़े रहते हैं क्योंकि नाभिक के मूल कणों (Nucleus) को बांधे रखने के लिए प्रयुक्त नाभिकीय बल का मान प्रोटॉनों के मध्य कार्यकारी प्रतिकर्षण बल से बहुत अधिक होता है। नाभिकीय बल केवल अत्यल्प दूरी (≈3 फर्मी) में ही प्रभावी होता है। इसकी उत्पत्ति पाई मेसॉनों के विनिमय से होती है। नाभिकीय बल अगुरुत्वीय, व अवैद्युत व आकर्षी प्रकृति के होते हैं।
नाभिक का स्थायित्व (Stability of Nucleus)
किसी नाभिक का स्थायित्व नाभिक में उपस्थित न्यूट्रॉनों व प्रोटॉनों के अनुपात पर निर्भर करता है। जिन परमाणुओं के नाभिक में न्यूट्रॉन व प्रोटॉन समान संख्या अर्थात् 1:1 के अनुपात में होते हैं वे सर्वाधिक स्थाई होते हैं। प्रोटॉनों के सापेक्ष न्यूट्रॉनों की संख्या बढ़ने से नाभिक का स्थायित्व घटता है। जब यह अनुपात 1.5 से अधिक हो जाता है तो नाभिक (या पदार्थ) रेडियोधर्मी हो जाता है और उसका स्वतः क्षय (decay) होने लगता है। कारण यह कि नाभिक में 82 से अधिक प्रोटॉन होने पर उनके मध्य लगने वाले प्रतिकर्षण बल का मान, नाभिकीय बल से अधिक हो जाता है।
परमाणु क्रमांक 82 से ऊपर के जितने भी तत्व हैं सभी में n/p का मान 1.5 से अधिक होता है फलतः उनमें रेडियो धार्मिता का गुण पाया जाता है।
समस्थानिक परमाणु (Isotope Atoms)
यदि किसी तत्व के विभिन्न परमाणुओं के नाभिकों में न्यूट्रॉनों की संख्या अलग-अलग होती है तो ऐसे परमाणु एक-दूसरे के समस्थानिक परमाणु होते हैं। अर्थात् एक ही तत्व के परमाणु जिनकी परमाणु संख्या समान हो लेकिन द्रव्यमान संख्या (Mass number) भिन्न-भिन्न हो, समस्थानिक परमाणु कहलाते हैं। जैसे- हाइड्रोजन (परमाणु सं0-1) के तीन समस्थानिक होते हैं-प्रोटियम (1H1) ड्यूटीरियम (1H2) व ट्राइटियम (1H3)। प्रोटियम के नाभिक में सिर्फ एक प्रोटॉन, ड्यूटीरियम के नाभिक में एक प्रोटॉन व एकं न्यूट्रॉन तथा ट्राइटियम के नाभिक में दो न्यूट्रॉन व एक प्रोटॉन होता है। ट्राइटियम के नाभिक में न्यूट्रॉनों व प्रोटॉनों का अनुपात 2:1 होता है। इसीलिए यह रेडियोधर्मिता भी प्रदर्शित करता है। समस्थानिकों के रासायनिक गुण तो समान होते हैं परन्तु भौतिक गुण भिन्न होते हैं।
समस्थानिकों के उपयोग (Uses of Isotopes)
(i) किसी पुराने कार्बनिक पदार्थ की आयु जानने हेतु कार्बन के समस्थानिक (C14) का उपयोग किया जाता है।
(ii) कैंसर के उपचार में कोबाल्ट के समस्थानिक (Co60) का उपयोग करते हैं।
(iii) परमाणु भट्टी (Atomic Reactor) में यूरेनियम के समस्थानिक U235 का उपयोग करते हैं।
(iv) घेघा रोग (Goiter) के उपचार में आयोडीन के समस्थानिक (I131) का उपयोग होता है।
(v) श्रृंखला अभिक्रियाओं में मंदक (Moderater) के रूप में हाइड्रोजन के समस्थानिक (ड्यूटीरियम) का उपयोग करते हैं।
(vi) शरीर में ट्यूमर का पता लगाने के लिए आर्सेनिक के समस्थानिक (As74) का प्रयोग किया जाता है।
समभारी परमाणु (Isobars)
विभिन्न तत्वों के ऐसे परमाणु जिनका परमाणु क्रमांक भिन्न होता है परन्तु द्रव्यमान संख्या (प्रोटॉनों व न्यूट्रॉनों की संख्याओं का योग) समान हो, समभारी परमाणु कहलाते हैं। जैसे-कैल्सियम (20P + 20N) व आर्गन (18P + 22N) दोनों तत्वों की द्रव्यमान संख्या 40 है। अतः इनके परमाणु समभारी कहे जाते हैं।
द्रव्यमान क्षति व बंधन ऊर्जा (Mass Defect and Binding Energy)
किसी परमाणु के नाभिक का द्रव्यमान (mass) उसमें उपस्थित प्रोटॉनों व न्यूट्रॉनों के द्रव्यमानों के अलग-अलग योग से कम होता है। तात्पर्य यह कि नाभिक का निर्माण करने में कुछ द्रव्यमान की क्षति हो जाती है। यह क्षति ऊर्जा के रूप में परिवर्तित हो जाती है जिसे सूत्र E = mc² से ज्ञात किया जा सकता है। जहां m = द्रव्यमान में हुई क्षति, c = प्रकाश का वेग व E उत्पन्न ऊर्जा है। यह ऊर्जा, बंधन ऊर्जा (Binding Energy) के रूप में नाभिक के कणों (Nucleons) को बांधे रखती है।
द्रव्यमान ऊर्जा की तुल्यता (Equivalence of Mass and Energy)
आइंस्टीन (1905) से पूर्व यह माना जाता था कि द्रव्यमान (mass) व ऊर्जा (Energy) दोनों परस्पर स्वतंत्र राशियां (Quantities) हैं जिनकी परस्पर कोई परिवर्तनीयता नहीं है। परन्तु आइंस्टीन ने यह सिद्ध किया कि दोनों एक-दूसरे से संबंधित हैं और द्रव्यमान को ऊर्जा में परिवर्तित किया जा सकता है। नाभिकीय ऊर्जाओं का मूलस्त्रोत यही है। उन्होंने बताया कि m किग्रा० द्रव्यमान की क्षति होने पर द्रव्यमान (m) × प्रकाश का वेग का वर्ग (c²) जूल के बराबर ऊर्जा उत्पन्न होती है। उदाहरणस्वरुप 1 किग्रा० द्रव्यमान की क्षति द्वारा 1 किग्रा. × 3 × (108 मी०/से०) 3.0 × 1016 जूल ऊर्जा उत्पन्न होती है। इस प्रकार नाभिकीय अभिक्रियाएं (नाभिकीय विखण्डन, नाभिकीय संलयन आदि) द्रव्यमान ऊर्जा संरक्षण नियम का पालन नहीं करतीं।
उल्लेखनीय है कि अर्नेस्ट रदरफोर्ड ने रॉयल सोसायटी के समक्ष कहा था कि मनुष्य को नाभिकीय शक्ति कभी नहीं प्राप्त होगी क्योंकि उन्हें विश्वास था कि आइंस्टीन का नियम फेल हो जायेगा और मात्रा ऊर्जा में परिवर्तित नहीं होगी परन्तु बाद में उनकी धारणा गलत साबित हुई।
रेडियो धर्मिता (Radioactivity)
जिन तत्वों का परमाणु क्रमांक 82 से अधिक होता है, उनमें प्रोटॉनों के मंध्य लगने वाला प्रतिकर्षण बल, नाभिकीय बल से अधिक हो जाता है। ऐसे तत्वों के नाभिक स्थाई नहीं रहते और स्थायित्व प्राप्त करने के लिए लगातार अल्फा (α), बीटा (β) व गामा (γ) नामक किरणों का उत्सर्जन करते रहते हैं। ऐसे तत्वों को रेडियोधर्मी (Radioactive) तत्त्व (Element) कहते हैं तथा इस प्रक्रिया को रेडियो धर्मिता (Radioactivity) कहते हैं।
ज्ञातव्य है कि रेडियोधर्मिता की खोज अचानक हो गई थी। सन् 1896 में फ्रांस के वैज्ञानिक हेनरी बेकुरल ने फ्रोटोग्राफिक फिल्म को काले पेपर में लपेट कर रख दिया। वहीं पास में यूरेनियम धातु का अयस्क रखा हुआ था। जब उन्होंने फिल्म को देखा तो वह खराब हो गया था। इससे उन्होंने निष्कर्ष निकाला कि जरुर उस पदार्थ (यूरेनियम) से कोई विकिरण उत्सर्जित हुआ है जिससे फोटोग्राफिक फिल्म प्रभावित हुई है। इसके बाद हेनरी बेकुरल, मैडम क्यूरी व उनके पति पियरे क्यूरी (1898) ने इस पर काफी शोध कार्य किया और पाया कि यूरेनियम के अलावा ऐसे बहुत से पदार्थ हैं जिनमें रेडियो धर्मिता पायी जाती है। जैसे- थोरियम (Th), पोलोनियम (Po) व रेडियम (Ra) इत्यादि। वर्ष 1902 में मैरी क्यूरी ने यूरेनियम के अयस्क पिचव्लैण्ड (U3O8) में एक नये तत्व रेडियम को खोजा, जो यूरेनियम की अपेक्षा लगभग 30 लाख गुना अधिक रेडियोधर्मी है।
जिस दर से किसी पदार्थ अथवा नमूने (Sample) के नाभिकों का क्षय होता है, उसे हम उस पदार्थ की क्षय दर (Decay Rate) या सक्रियता दर (Activity Rate) कहते हैं। इसका SI मात्रक बेकुरल (Bequerrel) होता है। 1 बेकुरल (Bq) = 1 क्षय/सेकण्ड । इसके बड़े मात्रक क्यूरी (Ci)) तथा रदरफोर्ड हैं। 1 रदरफोर्ड = 106 क्षय/सेकेण्ड या बेकुरल। 1 क्यूरी = 3.62 * 1010 बेकुरल।
अर्ध आयु (Half life Period)
किसी रेडियोधर्मी पदार्थ में किसी समय विशेष (Point of Time) पर उपस्थित परमाणुओं के आधे परमाणु जितने समय में विघटित हो जाते हैं, उस समयावधि (Period of Time) को उस तत्व की अर्ध आयु कहते हैं। यह प्रत्येक रेडियोधर्मी तत्त्व के लिए अलग-अलग व निश्चित (Fix) होती है। यथा-रेडियम की अर्ध आयु 1950 वर्ष, थोरियम की 1.4 * 1018 वर्ष व पोलोनियम की 1 * 10-4 सेकेण्ड व यूरेनियम 238 की 4.46 विलियन वर्ष होती है।
औसत आयु (Mean Life Time)
किसी रेडियोधर्मी परमाणु की औसत आयु सभी परमाणुओं के जीवन काल (Life Times) के योग को कुल परमाणुओं की संख्या से भाग देने पर प्राप्त होता है। अर्थात्
T = सभी परमाणुओं के जीवन कालों का योग/परमाणुओं की संख्या
यह, पदार्थ के क्षय नियतांक (1) के व्युत्क्रम (inverse) के बराबर होता है।
अर्थात् T = 1/λ
तत्वान्तरण (Transmutation)
किसी तत्व का दूसरे तत्व में परिवर्तित हो जाना, तत्वान्तरण कहलाता है। सर्वप्रथम सॉडी (Soddy) ने यह बताया कि बेकुरल किरणों (α, β Rays) का उत्सर्जन अस्थाई नाभिकों का स्थाई नाभिकों में परिवर्तन का परिणाम है। इसी के कारण रेडियोऐक्टिव समस्थानिकों (Radioactive Isotopes) का निर्माण होता है।
जैसे- यूरेनियम (92U238) परमाणु से एक अल्फाकण (2He4) का उत्सर्जन होने पर वह थोरियम (9Th234) के एक परमाणु में बदल जाता है।
अल्फाक्षय (Alfa-‘α’ Decay)
इसकी खोज हेनरी बेकुरल ने की थी। जब किसी रेडियो ऐक्टिव परमाणु से एक α कण का उत्सर्जन होता है तो उसके द्रव्यमान संख्या (mass number) में 4 की कमी व परमाणु संख्या में 2 की कमी हो जाती है। इस तरह अल्फाकण 1 हीलियम (2He4) परमाणु के नाभिक के बराबर (equivalent) होता है।
α कणों की मुख्य विशेषताएँ निम्नवत् हैं-
(i) इन पर दो इकाई धनावेश तथा द्रव्यमान 4 इकाई होता है।
(ii) इन्हें 2He4 से व्यक्त किया जाता है।
(iii) इनमें 2 प्रोटॉन तथा दो न्यूट्रॉन होते हैं।
इस प्रकार यह हीलियम नाभिक के समान होता है।
(iv) इनकी गति प्रकाश की 1/15 होती है।
(v) इनकी आयनन क्षमता (Ionising Power) बहुत अधिक (तीनों में सर्वाधिक) होती है।*
(vi) इनकी बेधन क्षमता बहुत कम (तीनों में सबसे कम) होती है।*
(vi) ये विद्युत क्षेत्र व चुम्बकीय क्षेत्र दोनों के ही द्वारा विक्षेपित (deflect) होती है।
(vii) ये स्फुरदीप्ति का गुण रखती हैं।
(viii) फोटो फिल्म को प्रभावित कर देती है।
(ix) धनावेशित होने के कारण कैथोड की ओर विचलित होती है।
बीटा क्षय (Beta- ẞ Decay)
• बीटा कणों या किरणों की खोज रदरफोर्ड ने की थी। ये किरणें तीव्र गति से गतिमान इलेक्ट्रॉनों से बनी होती है। इनका उत्सर्जन भी अस्थाई नाभिक के स्थायित्व प्राप्त करने की प्रक्रिया का परिणाम है। एक न्यूट्रॉन का क्षय (decay) होता है तो एक प्रोटॉन (1P1) एक इलेक्ट्रान (अर्थात् ẞ कण -1e०) व एक एण्टीन्यूट्रनो (v) उत्पन्न होता है। एक ẞ कण का उत्सर्जन होने पर परमाणु संख्या में एक इकाई की वृद्धि हो जाती है-
ẞ कणों की मुख्य विशेषताएँ निम्नवत् हैं-
(i) इन पर 1 इकाई का ऋणावेश व इनका विराम द्रव्यमान शून्य होता है।
(ii) इन किरणों की आयनन क्षमता गामा किरणों से 100 गुना होती है।*
(iii) इनकी वेधन क्षमता (Penetrating Power) अल्फा किरणों की 100 गुना होती है।*
(iv) ऋणावेशित होने के कारण एनोड की ओर विचलित होती हैं।
(v) इनकी गति प्रकाश की गति से थोड़ा कम (≈ 99%) होती है।
(vi) स्फुरदीप्ति प्रभाव प्रदर्शित करती हैं।
(vii) फोटो फिल्म को काला कर देती हैं।
(viii) इन पर विद्युत व चुम्बकीय दोनों क्षेत्रों का प्रभाव पड़ता है।
गामा क्षय (Gama ‘γ’ Decay)
इन किरणों की खोज मेरी और पियरे क्यूरी ने की थी। ये कम तरंग दैर्ध्य की विद्युत चुंबकीय तरंगें हैं, जो कि द्रव्यमान विहीन व आवेशविहीन ऊर्जा के बंडल (Photons) के रूप में उत्सर्जित होती हैं। इनके उत्सर्जन से परमाणु के द्रव्यमान संख्या व परमाणु संख्या में कोई परिवर्तन नहीं होता। इन किरणों के उत्सर्जन का नाभिक या परमाणु पर सिर्फ इतना प्रभाव पड़ता है कि यह उच्च ऊर्जा स्तर या उत्तेजित अवस्था से निम्न ऊर्जा स्तर या कम उत्तेजित अवस्था को प्राप्त हो जाता है। गामा किरणों की उपस्थिति का पता लगाने के लिए प्रस्फुरण गणक का प्रयोग करते है।
गामा किरणों की मुख्य विशेषताएं निम्नवत् हैं।
(i) गामा (γ) किरणों की चाल प्रकाश की चाल के बराबर होती है। * इसका तरंग दैर्ध्य 1A° के लगभग होता है।
(ii) इन किरणों की आयनन क्षमता बहुत कम (≈ 1% ofẞ Ray) होती है।
(iii) इनकी वेधन क्षमता ẞ किरणों की अपेक्षा 100 गुना होती है। यह 30 सेमी० मोटी स्टील की चादर को भी पार कर निकल जाती है।*
(iv) ये किरणें भी स्फुरदीप्ति (Fluore Scence) प्रभाव प्रदर्शित करती हैं।
(v) फोटोग्राफिक प्लेटों पर इनका प्रभाव सर्वाधिक होता है।*
(vi) चुम्बकीय व विद्युत क्षेत्रों का इन किरणों पर कोई प्रभाव नहीं पड़ता।
(vii) इनकी ऊर्जा व वेधन क्षमता विद्युत चुम्बकीय विकिरणों में सर्वाधिक होती है।*
रेडियो धर्मी श्रृंखला व सोडी फैजान का समूह विस्थापन का नियम (Radioactive series and Soddy Fajan’s Group Displacement Law)
सोडी फैजान नियम के अनुसार- एक अल्फाकण के उत्सर्जन के परिमाणस्वरुप द्रव्यमान सं० (Mass No.) में 4 इकाई की कमी व परमाणु क्रमांक (Atomic No.) में 2 इकाई की कमी होती है। एक बीटा कण के उत्सर्जन से परमाणु क्रमांक में 1 इकाई की वृद्धि हो जाती है परन्तु द्रव्यमान संख्या अपरिवर्तित रहती है। ४ किरणों के उत्सर्जन से परमाणु क्रमांक व द्रव्यमान संख्या में कोई परिवर्तन नहीं होता है। परन्तु इसके फलस्वरुप नाभिक उच्च ऊर्जा अवस्था से निम्न ऊर्जा अवस्था (lower energy State) में आ जाता है। परमाणु क्रमांक में परिवर्तन होने का तात्पर्य तत्व में परिवर्तन हो जाने से है अर्थात् रेडियोधर्मी क्षय के फलस्वरुप रेडियोधर्मी तत्व का परमाणु एक तत्व से परिवर्तित होकर दूसरे तत्व का परमाणु बन जाता है। तत्वान्तरण की यह प्रक्रिया तब तक चलती रहती है जब तक कि परमाणु स्थायित्व को नहीं प्राप्त हो जाता। ज्ञातव्य है कि अंत में सभी रेडियोधर्मी परमाणु लेड परमाणु में बदलकर स्थायित्व को प्राप्त होते हैं।
एक तत्त्व से दूसरे तत्व में परिवर्तन होते रहने के कारण रेडियो धर्मी तत्वों व समस्थानिकों की एक श्रृंखला बन जाती है जिसे रेडियोधर्मी श्रृंखला कहते हैं। चार महत्वपूर्ण रेडियोधर्मी श्रृंखलाएँ निम्न हैं-थोरियम श्रृंखला, यूरेनियम श्रृंखला, ऐक्टिनियम श्रृंखला व वप्ट्यूनियम श्रृंखला।
एकीकृत परमाणु द्रव्यमान मात्रक (Unified Atomic Mass Unit)
कार्बन (6C12) परमाणु के द्रव्यमान (mass) के बारहवें भाग (1/12th Part) को 1 परमाणु द्रव्यमान मात्रक (Atomic Mass Unit-amu) कहते हैं। इसी को एकीकृत परमाणु द्रव्यमान मात्रक भी कहते हैं और ‘a.m.u.’ अथवा ‘u’ से प्रदर्शित करते हैं। 1a.m.u का मान 1.66033 × 10-27 किग्रा० होता है। इस मात्रक की समतुल्य ऊर्जा 931MeV होती है। ज्ञातव्य है कि 1MeV = 1.6 × 10-13 जूल होता है।
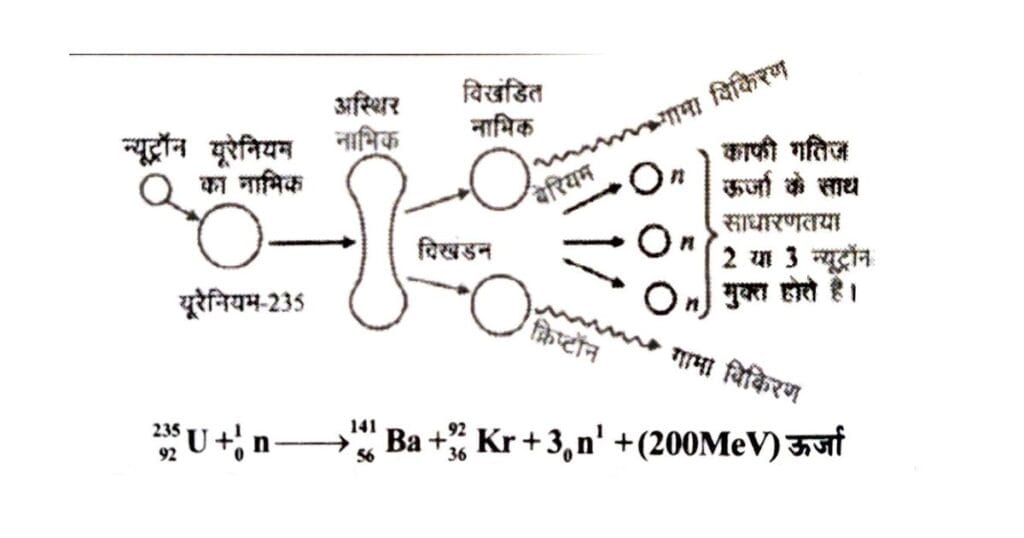
नाभिकीय विखंडन (Nuclear Fission)
किसी नाभिक के दो या अधिक छोटे नाभिकों में टूटने को नाभिकीय विखंडन कहते हैं। हॉन तथा स्ट्रासमैन नामक दो जर्मन वैज्ञानिकों ने सर्वप्रथम किसी नाभिक को तोड़ने में सफलता प्राप्त की। इन्होंने यूरेनियम परमाणु के नाभिक पर न्यूट्रॉनों की बमबारी (Bombordment) करके उसे दो भागों में तोड़ दिया। इस क्रिया में भारी मात्रा में ऊर्जा भी उत्पन्न होती है। विखंडन से निर्मित नाभिकों के द्रव्यमानों का योग विखंडन पूर्व नाभिक के द्रव्यमान से कम होता है। इसका कारण यह है कि नाभिक के टूटने पर कुछ द्रव्यमान की क्षति हो जाती है और यही द्रव्यमान क्षति, ऊर्जा में परिवर्तित हो जाती है। इस ऊर्जा की गणना भी हम आइस्टीन के सूत्र (द्रव्यमान ऊर्जा तुल्यता E = mc²) से कर सकते हैं। यूरेनियम नाभिक के विखण्डन को हम निम्नवत् प्रदर्शित कर सकते हैं-
92U235 + 0n1 → 56Ba141 + 36Kr92 +3 0n¹ + 200 MeV (Energy)
ज्ञातव्य है कि यूरेनियम के नाभिकीय विखंडन में बेरियम (Ba), क्रिप्टान (Kr) के समस्थानिकों के बजाय दूसरे समस्थानिक भी प्राप्त हो सकते हैं जिनके परमाणु क्रमांक 36 से 58 के मध्य व द्रव्यमान संख्याएँ 72 से 162 के मध्य हो सकती हैं। यूरेनियम – 235 के नाभिक का विखण्डन होने पर विभिन्न समस्थानिकों के साथ तीन न्यूट्रॉन व लगभग 200 MeV ऊर्जा मुक्त होती है। इस ऊर्जा को नाभिकीय ऊर्जा (Nuclear Energy) कहते हैं। यूरेनियम के एक नाभिक के विखण्डन के परिणामस्वरुप प्राप्त 200 MeV ऊर्जा 0.214 a.m.u द्रव्यमान क्षति का परिणाम होती है।
श्रृंखला अभिक्रिया (Chain Reaction)
जब न्यूट्रानों की बमबारी करके यूरेनियम के नाभिक का विखण्डन किया जाता है तो तीन नये न्यूट्रान मुक्त होते हैं जो कि अन्य तीन परमाणुओं का विखण्डन कर देते हैं जिससे पुनः प्रत्येक से तीन-तीन (कुल 9) न्यूट्रान मुक्त होते हैं जो पुनः दूसरे 9 परमाणुओं का विखण्डन कर देते हैं। इस प्रकार यह श्रृंखला चलती रहती है जब तक कि सभी परमाणु विखंडित न हो जायें। इसे ही हम श्रृंखला अभिक्रिया कहते हैं। यह दो प्रकार की होती है-
(i) अनियंत्रित श्रृंखला अभिक्रिया (Uncontrolled Chain Reaction)-जब एक बार विखण्डन प्रारम्भ होता है तो प्रारंभ हुई श्रृंखला अभिक्रिया इतनी तीव्र गति से होती है कि यह विस्फोटक स्थिति धारण कर लेती है। कारण यह है कि विखण्डित होने वाले परमाणुओं की संख्या गुणोत्तर श्रेणी (1, 3, 9, 27, 81………. के क्रम में बढ़ती है। इस अभिक्रिया में प्रचंड विस्फोट (Explosion) होता है। परमाणु बम (Atom Bomb) इसी सिद्धान्त पर बनाये जाते हैं।
(ii) नियंत्रित श्रृंखला अभिक्रिया (Controlled Chain Reaction)-यदि श्रृंखला अभिक्रिया के दौरान एक परमाणु के विखंडन से मुक्त तीन न्यूट्रानों में से दो को रास्ते में ही रोक लिया जाय तो परमाणु विखण्डन की प्रक्रिया नियंत्रित हो जाती है और क्रमशः एक-एक परमाणुओं का विखण्डन होता है। इस तरह ऊर्जा का विमुक्तिकरण धीरे-धीरे व लंबे समय तक होता है। इस प्रकार प्राप्त नाभिकीय ऊर्जा का प्रयोग रचनात्मक कार्यों या विद्युत निर्माण इत्यादि में किया जा सकता है। नियंत्रित श्रृंखला अभिक्रिया परमाणु भट्टी (Atomic Reactor) में संपन्न होती है। ज्ञातव्य है कि प्रथम परमाणु भट्टी एनरिको फर्मी ने सन् 1942 ई० में बनाया था।
यह भी पढ़ें : चुम्बकीय फ्लक्स (Magnetic Flux)
FAQs
Q1. भारत में नाभिकीय अनुसंधान के प्रारम्भ करने का श्रेय किस वैज्ञानिक को जाता है?
Ans. डा० होमी जहाँगीर भाभा को।
Q2. प्रोटॉनों के मध्य समान आवेश के कारण प्रतिकर्षण बल लगता है, फिर भी नाभिक में प्रोटॉन दृढ़ता से बँधे रहते हैं। क्यों?
Ans. दृढ़ नाभिकीय बल के कारण। नाभिकीय बल, प्रोटॉनों के मध्य परस्पर प्रतिकर्षण बल से अधिक होता है।
Q3. नाभिकीय बल का कार्यकारी परास (Range) क्या है?
Ans. 3 फर्मी (1) फर्मी = 10-15 मी.)
Q4. नाभिक में उपस्थित प्रोटॉनों की संख्या से क्या निर्धारित होता है?
Ans. तत्व का परमाणु क्रमांक ।
Q5. मेसॉन व पॉजीट्रॉन की खोज किसने की ?
Ans. हिडेकी युकावा व एण्डरसन ने।
Q6. किसी तत्त्व अथवा यौगिक का वह सूक्ष्मतम कण जो स्वतंत्र अवस्था में रह सकता है, कहलाता है-
Ans. अणु (Molecule)
Q7. इलेक्ट्रॉन को नाभिक के परितः घूर्णन के लिए आवश्यक अभिकेन्द्र बल कहाँ से मिलता है?
Ans. दोनों के बीच लगने वाले स्थिर वैद्युत आकर्षण बल से।
Q8. ट्रेसर तकनीक क्या है?
Ans. रेडियोधर्मी समस्थानिकों की सहायता से किसी चीज का पता लगाना। जैसे शरीर में कैंसर की खोज करना, पौधे ने किसी उर्वरक का कितना भाग ग्रहण किया, का पता लगाना तथा ऑटोमोबाइल्स के इंजनों के क्षयन (wear) की दर ज्ञात करना।
Q9. गामा किरणों का कृषि में क्या उपयोग है?
Ans. खाद्य पदार्थों के सूक्ष्म जीवों को मारना (Sterilizing) तथा फसलों को नुकसान पहुंचाने वाले कीटों (Pests) को नियंत्रित करना।
Q10. शरीर में रक्त के थक्के का पता लगाने के लिए किस समस्थानिक का प्रयोग करते हैं?
Ans. सोडियम-24 (Na24) का।
Q11. थायराइड ग्रंथि के कैंसर के उपचार के लिए किस समस्थानिक का प्रयोग किया जाता है?
Ans. आयोडीन-131 (I131)
Q12. आर्सेनिक के समस्थानिक (As) का चिकित्सकीय उपयोग क्या है?
Ans. मानव शरीर में किसी गांठ (Tumour) की खोज में।
Q13. कोबाल्ट-60 का मुख्य चिकित्सकीय उपयोग क्या है?
Ans. सामान्य कैंसर की पहचान करना

1 thought on “परमाणु (Atom)”