प्राचीन भारतीय एवं ग्रीक दार्शनिक द्रव्य के अज्ञात एवं अदृश्य रूपों से सदैव चकित होते रहे। पदार्थ की विभाज्यता के मत के बारे में भारत में बहुत पहले, लगभग 500 ईसा पूर्व विचार व्यक्त किया गया था।
भारतीय दार्शनिक महर्षि कनाड (Maharshi Kanad) ने प्रतिपादित किया था कि यदि हम द्रव्य (पदार्थ) को विभाजित करते जाएँ तो हमें छोटे-छोटे कण प्राप्त होते जाएँगे तथा अंत में एक सीमा आएगी जब प्राप्त कण को पुनः विभाजित नहीं किया जा सकेगा अर्थात् वह सूक्ष्मतम कण अविभाज्य रहेगा। इस अविभाज्य सूक्ष्मतम कण को उन्होंने परमाणु कहा। एक अन्य भारतीय दार्शनिक पकुधा कात्यायाम (Pakudha Katyayama) ने इस मत को विस्तृत रूप से समझाया तथा कहा कि ये कण सामान्यतः संयुक्त रूप में पाए जाते हैं, जो हमें द्रव्यों के भिन्न-भिन्न रूपों को प्रदान करते हैं।
लगभग इसी समय ग्रीक दार्शनिक डेमोक्रिटस (Democritus) एवं लियुसीपस (Leucippus) ने सुझाव दिया था कि यदि हम द्रव्य को विभाजित करते जाएँ, तो एक ऐसी स्थिति आएगी जब प्राप्त कण को पुनः विभाजित नहीं किया जा सकेगा। उन्होंने इन अविभाज्य कणों को परमाणु (अर्थात् अविभाज्य) कहा था। ये सभी सुझाव दार्शनिक विचारों पर आधारित थे। इन विचारों की वैधता सिद्ध करने के लिए 18वीं शताब्दी तक कोई अधिक प्रयोगात्मक कार्य नहीं हुए थे।
18वीं शताब्दी के अंत तक वैज्ञानिकों ने तत्वों एवं यौगिकों के बीच भेद को समझा तथा स्वाभाविक रूप से यह पता करने के इच्छुक हुए कि तत्व कैसे तथा क्यों संयोग करते हैं? जब तत्व परस्पर संयोग करते हैं, तब क्या होता है?
वैज्ञानिक आंतवाँ एल. लवाइजिए (Antonie L. Lavoisier) ने रासायनिक संयोजन के दो महत्वपूर्ण नियमों को स्थापित किया जिसने रसायन विज्ञान को महत्वपूर्ण आधार प्रदान किया।
लवाइजिए एवं जोजफ एल. प्राउस्ट (Joseph L. Proust) ने बहुत अधिक प्रायोगिक कार्यों के पश्चात् रासायनिक संयोजन के निम्नलिखित दो नियम प्रतिपादित किए।
3.1.1 द्रव्यमान संरक्षण का नियम
जब रासायनिक परिवर्तन (रासायनिक अभिक्रिया) संपन्न होता है, तब क्या द्रव्यमान में कोई परिवर्तन होता है?
क्रियाकलाप 3.1
निम्न X एवं Y रसायनों का एक युगल लीजिए।
| X | Y |
| कॉपर सल्फेट | सोडियम कार्बोनेट |
| बेरियम क्लोराइड | सोडियम सल्फेट |
| लेड नाइट्रेट | सोडियम क्लोराइड |
• X एवं Y युगलों की सूची में से किसी एक युगल के रसायनों के अलग-अलग विलयन 10 mL जल में तैयार कीजिए।
• उपरोक्त तैयार युगल विलयनों में से Y के विलयन को एक शंक्वाकार फ्लास्क में लीजिए एवं X के विलयन को एक छोटी परख नली में लीजिए।
• छोटी परख नली को विलय युक्त फ्लास्क में इस प्रकार लटकाइए ताकि दोनों विलयन परस्पर मिश्रित न हों। तत्पश्चात् फ्लास्क के मुख पर एक कार्क चित्र 3.1 की भाँति लगाइए।
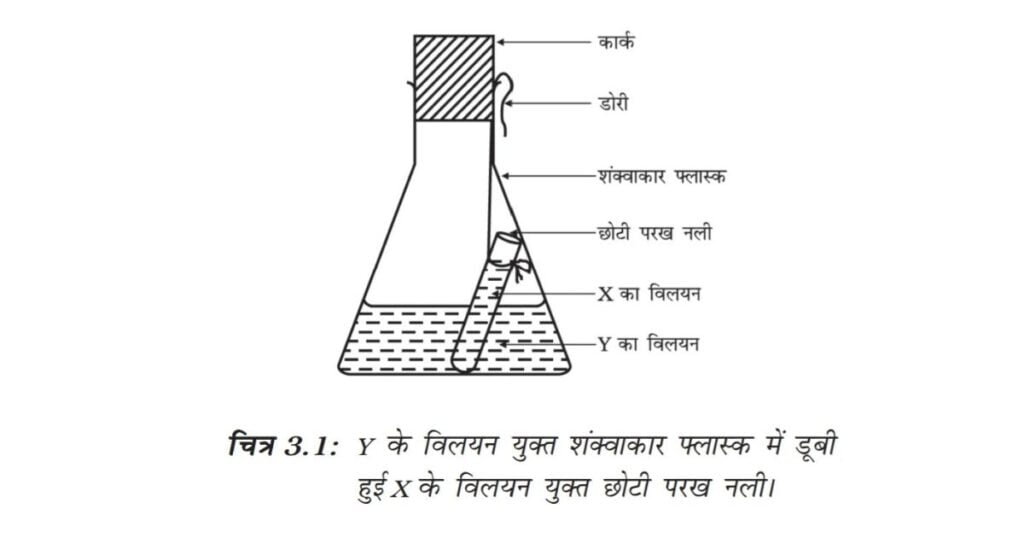
• अंर्तवस्तु युक्त फ्लास्क को सावधानीपूर्वक तौल लीजिए।
• अब फ्लास्क को झुकाकर इस प्रकार घुमाएँ जिससे X एवं Y के विलयन परस्पर मिश्रित हो जाएँ।
• अब इस फ्लास्क को पुनः तौल लीजिए। शंक्वाकार फ्लास्क में क्या अभिक्रिया हुई? क्या आप सोचते हैं कि कोई रासायनिक अभिक्रिया हुई?
• फ्लास्क के मुख पर कार्क क्यों लगाते हैं? क्या फ्लास्क के द्रव्यमान एवं अंतर्वस्तुओं में कोई परिवर्तन हुआ?
द्रव्यमान संरक्षण के नियम के अनुसार किसी रासायनिक अभिक्रिया में द्रव्यमान का न तो सृजन किया जा सकता है न ही विनाश।
3.1.2 स्थिर अनुपात का नियम
लवाइजिए एवं अन्य वैज्ञानिकों ने इस बात पर प्रकाश डाला कि कोई भी यौगिक दो या दो से अधिक तत्वों से निर्मित होता है। इस प्रकार प्राप्त यौगिकों में, इन तत्वों का अनुपात स्थिर होता है चाहे इसे किसी स्थान से प्राप्त किया गया हो अथवा किसी ने भी इसे बनाया हो।
यौगिक जल में हाइड्रोजन एवं ऑक्सीजन के द्रव्यमानों का अनुपात सदैव 1:8 होता है चाहे जल का स्रोत कोई भी हो। इसी प्रकार यदि 9 g जल का अपघटन करें तो सदैव 1 g हाइड्रोजन तथा 8g ऑक्सीजन ही प्राप्त होगी। इसी प्रकार अमोनिया (NH₃) में, नाइट्रोजन एवं हाइड्रोजन द्रव्यमानों के अनुसार सदैव 14:3 के अनुपात में विद्यमान रहते हैं, चाहे अमोनिया किसी भी प्रकार से निर्मित हुई हो अथवा किसी भी स्रोत से ली गई हो।
उपरोक्त उदाहरणों से स्थिर अनुपात के नियम की व्याख्या होती है जिसे निश्चित अनुपात का नियम भी कहते हैं। प्राउस्ट ने इस नियम को इस प्रकार से व्यक्त किया था “किसी भी यौगिक में तत्व सदैव एक निश्चित द्रव्यमानों के अनुपात में विद्यमान होते हैं”।
जॉन डाल्टन का जन्म सन् 1766 में इंग्लैंड के एक गरीब जुलाहा परिवार में हुआ था। बारह वर्ष की आयु में उन्होंने एक शिक्षक के रूप में अपनी जीविका शुरू की। सात साल बाद वह एक स्कूल के प्रिंसिपल बन गए। सन् 1793 में जॉन डाल्टन एक कॉलेज में गणित, भौतिकी एवं रसायन शास्त्र पढ़ाने के लिए मैनचेस्टर चले गए। वहाँ पर उन्होंने अपने जीवन का अधिकांश समय शिक्षण एवं शोधकार्य में व्यतीत किया। सन् 1808 में इन्होंने अपने परमाणु सिद्धांत को प्रस्तुत किया, जो द्रव्यों के अध्ययन के लिए एक महत्वपूर्ण सिद्धांत साबित हुआ।
वैज्ञानिकों की अगली समस्या इन नियमों की उचित व्याख्या करने की थी। अंग्रेज रसायनज्ञ, जॉन डाल्टन ने द्रव्यों की प्रकृति के बारे में एक आधारभूत सिद्धांत प्रस्तुत किया। डाल्टन ने द्रव्यों की विभाज्यता का विचार प्रदान किया जिसे उस समय तक दार्शनिकता माना जाता था। ग्रीक दार्शनिकों के द्वारा द्रव्यों के सूक्ष्मतम अविभाज्य कण, जिसे परमाणु नाम दिया था, उसे डाल्टन ने भी परमाणु नाम दिया। डाल्टन का यह सिद्धांत रासायनिक संयोजन के नियमों पर आधारित था। डाल्टन के परमाणु सिद्धांत ने द्रव्यमान के संरक्षण के नियम एवं निश्चित अनुपात के नियम की युक्तिसंगत व्याख्या की।
डाल्टन के परमाणु सिद्धांत के अनुसार सभी द्रव्य चाहे तत्व, यौगिक या मिश्रण हो, सूक्ष्म कणों से बने होते हैं जिन्हें परमाणु कहते हैं। डाल्टन के सिद्धांत की विवेचना निम्न प्रकार से कर सकते हैं :
(i) सभी द्रव्य परमाणुओं से निर्मित होते हैं, जो कि रासायनिक अभिक्रिया में भाग लेते हैं।
(ii) परमाणु अविभाज्य सूक्ष्मतम कण होते हैं जो रासायनिक अभिक्रिया में न तो सृजित होते हैं न ही उनका विनाश होता है।
(iii) दिए गए तत्व के सभी परमाणुओं का द्रव्यमान एवं रासायनिक गुणधर्म समान होते हैं।
(iv) भिन्न-भिन्न तत्वों के परमाणुओं के द्रव्यमान एवं रासायनिक गुणधर्म भिन्न-भिन्न होते हैं।
(v) भिन्न-भिन्न तत्वों के परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक निर्मित करते हैं।
(vi) किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं।
आप अगले अध्याय में यह अध्ययन करेंगे कि परमाणु में और भी छोटे-छोटे कण विद्यमान होते हैं।
3.2 परमाणु क्या क्या होता है?
क्या आपने कभी किसी इमारत की दीवार बनते देखी है? इन दीवारों से एक कमरा एवं कई कमरों के समूह से एक इमारत निर्मित होती है। उस विशाल इमारत की रचनात्मक इकाई क्या है? किसी बाँबी (Ant-Hill) की रचनात्मक इकाई क्या होती है? यह रेत का छोटा-सा कण होता है। इसी प्रकार, सभी द्रव्यों की रचनात्मक इकाई परमाणु होती है।
परमाणु कितने बड़े होते हैं?
परमाणु बहुत छोटे होते हैं। ये किसी भी वस्तु, जिसकी हम कल्पना या तुलना कर सकते हैं, से भी छोटे होते हैं। लाखों परमाणुओं को जब एक के ऊपर एक चट्टे के रूप में रखें, तो बड़ी कठिनाई से कागज की एक शीट जितनी मोटी परत बन पाएगी।
परमाणु त्रिज्या को नेनोमीटर (nm) में मापा जाता है।
| उदाहरण | त्रिज्या (मीटर में) |
| हाइड्रोजन परमाणु | 10-10 |
| जल अणु | 10-9 |
| हीमोग्लोबिन अणु | 10-8 |
| रेत कण | 10-4 |
| चींटी | 10-3 |
जब परमाणु का आकार इतना सूक्ष्म है कि हम इसे नगण्य मान सकते हैं, तो हम इसके बारे में क्यों सोचें? हम इसके बारे में इसलिए सोचते हैं क्योंकि हमारा पूरा विश्व ही परमाणुओं से बना है। चाहे हम उन्हें देख नहीं सकें, फिर भी वे यहाँ विद्यमान हैं तथा हमारे प्रत्येक क्रियाकलापों पर उनका प्रभाव पड़ता रहता है। अब हम आधुनिक तकनीकों की सहायता से तत्वों की सतहों के आवर्धित प्रतिबिंबों को दिखा सकते हैं, जिनमें उपस्थित परमाणु स्पष्ट दिखाई देते हैं।

3.2.1 विभिन्न तत्वों के परमाणुओं के आधुनिक प्रतीक क्या हैं?
डाल्टन ऐसे प्रथम वैज्ञानिक थे, जिन्होंने तत्वों के प्रतीकों का प्रयोग अत्यंत विशिष्ट अर्थ में किया। जब उन्होंने किसी तत्व के प्रतीक का प्रयोग किया, तो यह प्रतीक उस तत्व की एक निश्चित मात्रा की ओर इंगित करता था अर्थात् यह प्रतीक तत्व के एक परमाणु को प्रदर्शित करता था। बर्जिलियस ने तत्वों के ऐसे प्रतीकों का सुझाव दिया, जो उन तत्वों के नामों के एक या दो अक्षरों से प्रदर्शित होता था।

प्रारंभ में तत्वों के नामों के नामों की व्युत्पत्ति उन स्थानों के नामों से की गई, जहाँ वे सर्वप्रथम पाए गए थे। उदाहरणस्वरूप, कॉपर (Copper) का नाम साइप्रस (Cyprus) से व्युत्पन्न हुआ। कुछ तत्वों के नामों को विशिष्ट रंगों से लिया गया। उदाहरणस्वरूप, स्वर्ण (gold) का नाम अंग्रेजी के उस शब्द से लिया गया, जिसका अर्थ होता है पीला।
इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री (IUPAC) एक अन्र्तराष्ट्रीय वैज्ञानिक संस्था है जो तत्वों के नामों, प्रतीकों और मात्रकों को स्वीकृति प्रदान करती है। अधिकतर तत्वों के प्रतीक उन तत्वों के अंग्रेजी नामों के एक या दो अक्षरों से बने होते हैं। किसी प्रतीक के पहले अक्षर को सदैव बड़े अक्षर (capital letter) में तथा दूसरे अक्षर को छोटे अक्षर (small letter) में लिखा जाता है।
उदाहरणार्थ
(1) हाइड्रोजन, H
(ii) ऐलुमिनियम, Al न कि AL
(iii) कोबाल्ट, Co न कि CO
कुछ तत्वों के प्रतीक उनके अंग्रेजी नामों के प्रथम अक्षर तथा बाद में आने वाले किसी एक अक्षर को संयुक्त करके बनाते हैं। उदाहरण: (1) क्लोरीन, Cl, (ii) जिंक, Zn इत्यादि।
अन्य तत्वों के प्रतीकों को लैटिन, जर्मन या ग्रीक भाषाओं में उनके नामों से बनाया गया है। उदाहरणार्थः लौह (Iron) का प्रतीक Fe है, जो उसके लैटिन नाम फेरम से व्युत्पन्न किया गया है। इसी प्रकार सोडियम का प्रतीक Na तथा पोटैशियम का प्रतीक K क्रमशः नैट्रियम एवं केलियम से व्युत्पन्न हैं। इस प्रकार प्रत्येक तत्व का एक नाम एवं एक अद्वितीय रासायनिक प्रतीक होता है।

(जब कभी आप तत्वों का अध्ययन करें, तो आपके संदर्भ के लिए उपरोक्त सारणी दी गई है। इस पूरी सारणी को एक बार में याद करने की आवश्यकता नहीं है। समय-समय पर एवं बार-बार उपयोग करते रहने से आप स्वतः ही इन प्रतीकों को निर्मित करना सीख जाएँगे।)
3.2.2 परमाणु द्रव्यमान
डाल्टन के परमाणु सिद्धांत की सबसे विशिष्ट संकल्पना परमाणु द्रव्यमान की थी। उनके अनुसार प्रत्येक तत्व का एक अभिलाक्षणिक परमाणु द्रव्यमान होता है। डाल्टन का सिद्धांत स्थिर अनुपात के नियम को इतनी भली-भाँति समझाने में समर्थ था कि वैज्ञानिक इससे प्रेरित होकर परमाणु द्रव्यमान को मापने की ओर अग्रसर हुए। चूँकि एक परमाणु के द्रव्यमान को ज्ञात करना अपेक्षाकृत कठिन कार्य था इसलिए रासायनिक संयोजन के नियमों के उपयोग एवं उत्पन्न यौगिकों के द्वारा सापेक्ष परमाणु द्रव्यमानों को ज्ञात किया गया।
हम यहाँ पर एक यौगिक, कार्बन मोनोक्साइड (CO) का उदाहरण लेते हैं, जो कार्बन एवं ऑक्सीजन द्वारा निर्मित होता है। प्रायोगिक तौर पर यह निरीक्षित किया गया कि 3g कार्बन तथा 4 g ऑक्सीजन के संयोजन से कार्बन मोनोक्साइड निर्मित हुई है। दूसरे शब्दों में कहा जा सकता है कि कार्बन अपने 4/3 गुणा अधिक द्रव्यमान वाले ऑक्सीजन के साथ संयुक्त होती है। मान लीजिए, हम परमाणु द्रव्यमान की इकाई को एक कार्बन परमाणु द्रव्यमान के बराबर मानते हैं तो कार्बन परमाणु को 1.0 u तथा ऑक्सीजन परमाणु द्रव्यमान को 1.33 u निर्दिष्ट करेंगे। (प्रारंभ में परमाणु द्रव्यमान को amu द्वारा संक्षेप में लिखते थे, लेकिन आजकल IUPAC के नवीनतम अनुमोदन द्वारा इसको ‘u’ – यूनीफाइड द्रव्यमान द्वारा प्रदर्शित करते हैं।) लेकिन द्रव्यमानों की इकाई को यथासंभव पूर्णांक या लगभग पूर्णांक में व्यक्त करना अधिक सुविधाजनक होता है। आगे चलकर वैज्ञानिकों ने परमाणु द्रव्यमानों की भिन्न-भिन्न इकाइयों के बारे में विचार व्यक्त किए। वैज्ञानिक जब विभिन्न परमाणु द्रव्यमानों की इकाइयों के बारे में शोधरत थे तो उन्होंने प्रारंभ में प्रकृतिजन्य ऑक्सीजन परमाणु के द्रव्यमान के 1/16 भाग को इकाई के रूप में लिया। दो कारणों से इसे सुसंगत समझा गयाः
• ऑक्सीजन अनेक तत्वों के साथ अभिक्रिया करके यौगिक बनाता है।
• इस परमाणु द्रव्यमान इकाई द्वारा अधिकांश तत्वों के परमाणु द्रव्यमान पूर्णाक में प्राप्त होते हैं।
तथापि, 1961 में परमाणु द्रव्यमानों को ज्ञात करने के लिए परमाणु द्रव्यमान इकाई कार्बन-12 समस्थानिक (आइसोटोप) को मानक संदर्भ के रूप में सार्वभौमिक रूप से स्वीकार किया गया था। कार्बन-12 समस्थानिक के एक परमाणु द्रव्यमान के 1/12 वें भाग को मानक परमाणु द्रव्यमान इकाई के रूप में लेते हैं। कार्बन-12 समस्थानिक के एक परमाणु द्रव्यमान के सापेक्ष सभी तत्वों के परमाणु द्रव्यमान प्राप्त किए गए।
कल्पना कीजिए कि एक फल विक्रेता बिना मानक भार के फल बेच रहा है। वह एक तरबूज लेकर कहता है कि “इसका द्रव्यमान 12 इकाई है” (12 तरबूजीय इकाई अथवा 12 फल द्रव्यमान इकाई)। वह तरबूज के 12 बराबर टुकड़े करता है तथा पाता है कि उसके द्वारा बेचे जा रहे प्रत्येक फल का द्रव्यमान तरबूज के एक टुकड़े के द्रव्यमान के सापेक्ष है। जैसा कि चित्र 3.4 में दिखाया गया है, अब वह फलों को सापेक्ष फल द्रव्यमान इकाई (fmu) में बेचता है।

चित्र 3.4 : (a) तरबूज (b) भाग (d) तरबूज 12 टुकड़े (c) तरबूज के टुकड़ों का का 1/12 वाँ उपयोग करके वह फल विक्रेता फलों को कैसे तौल सकता है
किसी तत्व के सापेक्षिक परमाणु द्रव्यमान को उसके परमाणुओं के औसत द्रव्यमान का कार्बन-12 परमाणु के द्रव्यमान के 1/12 वें भाग के अनुपात द्वारा परिभाषित किया जाता है।
सारणी 3.2: कुछ तत्वों के परमाणु द्रव्यमान
| तत्व | परमाणु द्रव्यमान (u) |
| हाइड्रोजन | 1 |
| कार्बन | 12 |
| नाइट्रोजन | 14 |
| ऑक्सीजन | 16 |
| सोडियम | 23 |
| मैग्नीशियम | 24 |
| सल्फर | 32 |
| क्लोरीन | 35.5 |
| कैल्सियम | 40 |
3.2.3 परमाणु किस प्रकार अस्तित्व में रहते हैं?
अधिकांश तत्वों के परमाणु स्वतंत्र रूप से अस्तित्व में नहीं रह पाते। परमाणु अणु एवं आयन बनाते हैं। ये अणु अथवा आयन अत्यधिक संख्या में पुंजित होकर वह द्रव्य बनाते हैं, जिसे हम देख सकते हैं, अनुभव कर सकते हैं अथवा छू सकते हैं।
3.3. अणु क्या है?
साधारणतया अणु ऐसे दो या दो से अधिक परमाणुओं का समूह होता है जो आपस में रासायनिक बंध द्वारा जुड़े होते हैं अथवा वे परस्पर आकर्षण बल के द्वारा कसकर जुड़े होते हैं। अणु को किसी तत्व अथवा यौगिक के उस सूक्ष्मतम कण के रूप में परिभाषित कर सकते हैं जो स्वतंत्र रूप से अस्तित्व में रह सकता है तथा जो उस यौगिक के सभी गुणधर्म को प्रदर्शित करता है। एक ही तत्व के परमाणु अथवा भिन्न-भिन्न तत्वों के परमाणु परस्पर संयोग करके अणु निर्मित करते हैं।
3.3.1 तत्वों के अणु
किसी तत्व के अणु एक ही प्रकार के परमाणुओं द्वारा संरचित होते हैं। आर्गन (Ar), हीलियम (He) इत्यादि जैसे अनेक तत्वों के अणु उसी तत्व के केवल एक परमाणु द्वारा निर्मित होते हैं। लेकिन अधिकांश अधातुओं में ऐसा नहीं होता है। उदाहरणार्थ, ऑक्सीजन अणु दो ऑक्सीजन परमाणुओं से बनता है, इसलिए इसे द्वि-परमाणुक अणु, O₂ कहते हैं। यदि सामान्यतः 2 के स्थान पर 3 ऑक्सीजन परमाणु परस्पर संयोग करते हैं तो हमें ओजोन, O₃ प्राप्त होता है। किसी अणु की संरचना में प्रयुक्त होने वाले परमाणुओं की संख्या को उस अणु की परमाणुकता कहते हैं।
धातु अणुओं एवं कुछ अन्य तत्वों के अणुओं जैसे कि कार्बन के अणुओं की सरल संरचना नहीं होती है किंतु उनके अणुओं में असीमित परमाणु परस्पर बँधे होते हैं।
आइए, कुछ तत्वों की परमाणुकता का अवलोकन करें।
सारणी 3.3: कुछ तत्वों की परमाणुकता
| तत्वों के प्रकार | नाम | परमाणुकता |
| अधातु | आर्गन हीलियम ऑक्सीजन हाइड्रोजन नाइट्रोजन क्लोरीन फॉस्फोरस सल्फर | एक परमाणुक एक परमाणुक द्विपरमाणुक द्विपरमाणुक द्विपरमाणुक द्विपरमाणुक चतुर्परमाणुक बहुपरमाणुक |
| धातु | सोडियम आयरन ऐलुमिनियम कॉपर | एकपरमाणुक एकपरमाणुक एकपरमाणुक एकपरमाणुक |
3.3.2 यौगिकों के अणु
भिन्न-भिन्न तत्वों के परमाणु एक निश्चित अनुपात में परस्पर जुड़कर यौगिकों के अणु निर्मित करते हैं। सारणी 3.4 में कुछ उदाहरण दिए गए हैं।
सारणी 3.4: कुछ यौगिकों के अणु
| यौगिक | संयुक्त तत्व | द्रव्यमान अनुपात |
| जल | हाइड्रोजन, ऑक्सीजन | 1:8 |
| अमोनिया | नाइट्रोजन, हाइड्रोजन | 14:3 |
| कार्बन डाइऑक्साइड | कार्बन, ऑक्सीजन | 3:8 |
क्रियाकलाप 3.2
• अणुओं में विद्यमान परमाणुओं के द्रव्यमान अनुपातों के लिए सारणी 3.4 एवं तत्वों के परमाणु द्रव्यमानों के लिए सारणी 3.2 देखिए। सारणी 3.4 में दिए गए यौगिकों के अणुओं में प्रयुक्त तत्वों के परमाणुओं की संख्या के अनुपातों को ज्ञात कीजिए।
• जल अणु में प्रयुक्त परमाणुओं की संख्याओं का अनुपात निम्न प्रकार से प्राप्त किया जा सकता है:
| तत्व | द्रव्यमान अनुपात | परमाणु द्रव्यमान (u) | द्रव्यमान अनुपात / परमाणु द्रव्यमान | सरलतम अनुपात |
| H O | 1 8 | 1 16 | 1/1=1 8/16=1/2 | 2 1 |
• इस प्रकार, जल अणु में प्रयुक्त परमाणुओं की संख्याओं का अनुपात H:O = 2:1
3.3.3 आयन क्या होता है?
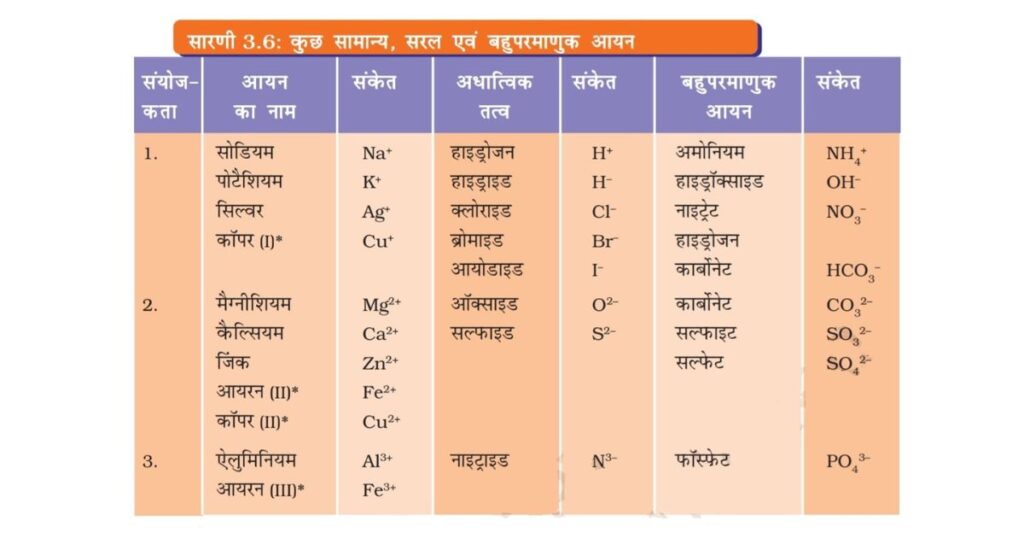
धातु एवं अधातु युक्त यौगिक आवेशित कणों से बने होते हैं। इन आवेशित कणों को आयन कहते हैं। आयन एक आवेशित परमाणु अथवा परमाणुओं का एक ऐसा समूह होता है जिस पर नेट आवेश विद्यमान होता है। यह ऋण आवेश अथवा धन आवेश होता है। ऋण आवेशित आयन को ऋणायन (anion) तथा धन आवेशित आयन को धनायन (cation) कहते हैं। उदाहरण के लिए सोडियम क्लोराइड (NaCl) को लीजिए। इसमें धनात्मक सोडियम आयन (Na+) तथा ऋणात्मक क्लोराइड आयन (Cl–) संघटक कण के रूप में विद्यमान होते हैं। परमाणुओं के समूह जिन पर नेट आवेश विद्यमान हो उसे बहुपरमाणुक आयन कहते हैं (सारणी 3.6)। हम आयनों के निर्माण के बारे में अध्याय-4 में और अधिक जानकारी प्राप्त करेंगे।
सारणी 3.5: कुछ आयनिक यौगिक
| आयनिक यौगिक | संघटक तत्व | द्रव्यमान अनुपात |
| कैल्सियम ऑक्साइड | कैल्सियम एवं ऑक्सीजन | 5:2 |
| मैग्नीशियम सल्फाइड | मैग्नीशियम एवं सल्फर | 3:4 |
| सोडियम क्लोराइड | सोडियम एवं क्लोरीन | 23:35.5 |
3.4 रासायनिक सूत्र लिखना
किसी यौगिक का रासायनिक सूत्र उसके संघटक का प्रतीकात्मक निरूपण होता है। भिन्न-भिन्न यौगिकों के रासायनिक सूत्र सरलतापूर्वक लिखे जा सकते हैं। इस अभ्यास के लिए हमें तत्वों के प्रतीकों एवं उनकी संयोजन क्षमताएँ ज्ञात होनी चाहिए।
किसी तत्व की संयोजन शक्ति (अथवा क्षमता) उस तत्व की संयोजकता कहलाती है। किसी एक तत्व के परमाणु दूसरे तत्व के परमाणुओं के साथ किस प्रकार से संयुक्त होकर एक रासायनिक यौगिक का निर्माण करते हैं? इसको ज्ञात करने के लिए संयोजकता का उपयोग करते हैं। किसी तत्व के परमाणु की संयोजकता को उसके हाथ अथवा भुजा के रूप में विचार किया जा सकता है।
मानव की दो भुजाएँ तथा ऑक्टोपस की आठ भुजाएँ होती हैं। ऑक्टोपस की एक भुजा मानव की केवल एक भुजा पकड़ सकती है। यदि एक ऑक्टोपस को कुछ मानवों को इस प्रकार से पकड़ना है कि उसकी आठ भुजाएँ मानवों की दोनों भुजाओं के साथ प्रयुक्त हो जाएँ तो आपके विचार में ऑक्टोपस कुल कितने मानवों को पकड़ सकता है? अब ऑक्टोपस को O तथा मानव को H से निरूपित कीजिए। क्या आप इस संयोजन के लिए सूत्र लिख सकते हैं? क्या आप OH4 को सूत्र के रूप में प्राप्त करेंगे? पादांक 4 ऑक्टोपस द्वारा पकड़े गए मानवों की संख्या को प्रदर्शित करता है।
सारणी 3.6 में कुछ सरल एवं बहुपरमाणुक आयनों की संयोजकताएँ दी गई हैं। संयोजकता के बारे में हम और अधिक जानकारी अगले अध्याय में प्राप्त करेंगे। रासायनिक सूत्र लिखते समय आपको निम्न नियमों का पालन करना चाहिए:
• आयन की संयोजकता अथवा आवेश संतुलित होना चाहिए।
• जब एक यौगिक किसी धातु एवं अधातु के संयोग से निर्मित होता है तो धातु के नाम अथवा उसके प्रतीक को रासायनिक सूत्र में पहले लिखते हैं। उदाहरणार्थ: कैल्सियम ऑक्साइड (CaO), सोडियम क्लोराइड (NaCl), आयरन सल्फाइड (FeS), कॉपर ऑक्साइड (CuO) … इत्यादि, जहाँ पर ऑक्सीजन, क्लोरीन, सल्फर अधातुएँ हैं तथा उन्हें दायीं तरफ लिखते हैं, जबकि कैल्सियम, सोडियम, आयरन एवं कॉपर धातुएँ हैं तथा उन्हें बायीं तरफ लिखते हैं।
• बहुपरमाणुक आयनों द्वारा निर्मित यौगिकों में आयनों की संख्या दर्शाने के लिए आयन को कोष्ठक में लिखकर आयनों की संख्या कोष्ठक के बाहर लिखते हैं उदाहरण Mg(OH)₂, है। यदि बहुपरमाणुक आयन की संख्या 1 हो तो कोष्ठक की आवश्यकता नहीं होती। उदाहरण के लिए NaOH |
3.4.1 सरल यौगिकों के सूत्र
दो भिन्न-भिन्न तत्वों से निर्मित सरलतम यौगिकों को द्विअंगी यौगिक कहते हैं। सारणी 3.6 में कुछ आयनों की संयोजकताएँ दी गई हैं। आप इनका उपयोग यौगिकों के सूत्रों को लिखने के लिए कर सकते हैं। आण्विक यौगिकों के रासायनिक सूत्र लिखते समय हम पहले संघटक तत्वों के प्रतीक लिखकर उनकी संयोजकताएँ लिखते हैं जैसा कि निम्न उदाहरणों में दर्शाया गया है। तत्पश्चात् संयोजित परमाणुओं की संयोजकताओं को क्रॉस करके (cross over) अणु सूत्र लिखते हैं।
उदाहरण
1. हाइड्रोजन क्लोराइड का सूत्र
हाइड्रोजन क्लोराइड का रासायनिक सूत्र HCI है।
2. हाइड्रोजन सल्फाइड के सूत्र
हाइड्रोजन सल्फाइड का सूत्र : H,S है।
3. कार्बन टेट्राक्लोराइड का सूत्र
कार्बन टेट्राक्लोराइड का सूत्र : CCl₄, है।
मैग्नीशियम क्लोराइड का सूत्र ज्ञात करने के लिए पहले हम धनायन का संकेत (Mg2+) लिखते हैं इसके पश्चात् ऋणायन क्लोराइड (Cl–) लिखते हैं। तत्पश्चात् इनके आवेशों को आड़ा-तिरछा करके हम सूत्र प्राप्त करते हैं।
4. मैग्नीशियम क्लोराइड का सूत्र : MgCl₂
इस प्रकार हम देखते हैं कि मैग्नीशियम क्लोराइड के अणु में दो क्लोराइड आयन (Cl–) प्रत्येक मैग्नीशियम आयन (Mg2+) के लिए होता है। इस प्रकार के आयनिक यौगिकों में धनात्मक तथा ऋणात्मक आवेशों का संतुलन होना चाहिए तथा संपूर्ण संरचना उदासीन होनी चाहिए। ध्यान देने योग्य बात यह है कि इस प्रकार के सूत्रों में आयनों के आवेशों को नहीं दर्शाया जाता है।
5. ऐलुमिनियम ऑक्साइड का सूत्रः Al₂O₃
6. कैल्सियम ऑक्साइड का सूत्रः
यहाँ पर दोनों तत्वों की संयोजकताएँ समान हैं। अतः इसका सूत्र Ca₂O₂ प्राप्त होगा, किंतु हम इस सूत्र को CaO के रूप में सरलीकृत करते हैं।
बहुपरमाणुक आयनों वाले यौगिक
सोडियम नाइट्रेट का सूत्र : NaNO₃
कैल्सियम हाइड्रॉक्साइड का सूत्रः Ca(OH)₂
ध्यान देने योग्य बात यह है कि कैल्सियम हाइड्रॉक्साइड का सूत्र Ca (OH), है न कि CaOH₂ 2 जब सूत्र में एक ही आयन के दो या दो से अधिक आयन होते हैं तो हम उनके लिए कोष्ठक का उपयोग करते हैं। यहाँ पर OH को कोष्ठक में रखकर पादांक 2 लगाते हैं जो यह निर्दिष्ट करता है कि एक कैल्सियम परमाणु के साथ दो हाइड्रोक्सील समूह जुड़े हैं। दूसरे शब्दों में, कैल्सियम हाइड्रॉक्साइड में ऑक्सीजन एवं हाइड्रोजन प्रत्येक के दो-दो परमाणु हैं।
सोडियम कार्बोनेट का सूत्रः Na₂CO₃
उपरोक्त उदाहरण में कोष्ठक के उपयोग की आवश्यकता नहीं है क्योंकि बहुपरमाणुक आयन कार्बोनेट का एक ही आयन विद्यमान है।
अमोनियम सल्फेट का सूत्रः (NH)₂SO₄
3.5 आण्विक द्रव्यमान
3.5.1 आण्विक द्रव्यमान
अनुभाग 3.2.2 में हम परमाणु द्रव्यमान की अवधारणा की विवेचना कर चुके हैं। इस अवधारणा का विस्तार आण्विक द्रव्यमानों का परिकलन करने के लिए किया जा सकता है। किसी पदार्थ का आण्विक द्रव्यमान उसके सभी संघटक परमाणुओं के द्रव्यमानों का योग होता है। इस प्रकार यह अणु का वह सापेक्ष द्रव्यमान है जिसे परमाणु द्रव्यमान इकाई (u) द्वारा व्यक्त किया जाता है।
उदाहरण 3.1 (a) जल (H₂O) के सापेक्ष आण्विक द्रव्यमान का परिकलन कीजिए।
(b) नाइट्रिक अम्ल (HNO₃ ) के आण्विक द्रव्यमान का परिकलन कीजिए।
हल:
(a) हाइड्रोजन का परमाणु द्रव्यमान = 1 u तथा ऑक्सीजन का परमाणु द्रव्यमान = 16 u है।
अतः जल, जिसमें दो परमाणु हाइड्रोजन एवं एक परमाणु ऑक्सीजन होते हैं, का आण्विक द्रव्यमान = 2 x 1+ 1×16 = 18 u होगा।
(b) नाइट्रिक अम्ल (HNO₃ ) के आण्विक द्रव्यमान = H का परमाणु द्रव्यमान + N का परमाणु द्रव्यमान + 3 × 0 का परमाणु द्रव्यमान हाइड्रोजन का परमाणु द्रव्यमान = 1 u
ऑक्सीजन का परमाणु द्रव्यमान 16 u तथा
नाइट्रोजन का परमाणु द्रव्यमान = 14 u होता है।
अतः HNO₃ का आण्विक द्रव्यमान। = 1u + 14 u+ 3×16 u = 63 u है।
3.5.2 सूत्र इकाई द्रव्यमान
किसी पदार्थ का सूत्र इकाई द्रव्यमान उसके सभी संघटक परमाणुओं के परमाणु द्रव्यमानों का योग होता है। सूत्र द्रव्यमान का परिकलन उसी प्रकार से करते हैं जिस प्रकार से हमने आण्विक द्रव्यमान का परिकलन किया है। अंतर केवल इतना होता है कि यहाँ पर हम उस पदार्थ के लिए सूत्र इकाई का उपयोग करते हैं, जिसके संघटक आयन होते हैं। उदाहरणार्थ: सोडियम क्लोराइड (इकाई सूत्र NaCl)। इसके इकाई सूत्र द्रव्यमान का परिकलन निम्न प्रकार से करते हैं: 1 x 23 u+ 1×35.5 u = 58.5 u
उदाहरण 3.2 CaCl₂ के सूत्र इकाई द्रव्यमान का परिकलन कीजिए
हलः कैल्सियम क्लोराइड का सूत्र इकाई द्रव्यमान CaCl₂ है। कैल्सियम (Ca) का परमाणु द्रव्यमान = 40 u क्लोरीन (CI) का परमाणु द्रव्यमान = 35.5 u अतः CaCl₂, का सूत्र इकाई द्रव्यमान 1x 40 u + 2 × 35.5 u = 40 u + 71 u = 111 u
आपने क्या सीखा
• किसी भी अभिक्रिया में, अभिकारकों और उत्पादों के द्रव्यमानों का योग अपरिवर्तनीय होता है। यह द्रव्यमान के संरक्षण का नियम कहलाता है।
• एक शुद्ध रासायनिक यौगिक में तत्व हमेशा द्रव्यमानों के निश्चित अनुपात में विद्यमान होते हैं, इसे निश्चित अनुपात का नियम कहते हैं।
• तत्व का सूक्ष्मतम कण परमाणु होता है, जो स्वतंत्र रूप से प्रायः नहीं रह सकता है तथा उसके सभी रासायनिक गुणधर्मों को प्रदर्शित करता है।
• अणु, किसी तत्व अथवा यौगिक का वह सूक्ष्मतम कण होता है जो सामान्य दशाओं में स्वतंत्र रह सकता है। यह पदार्थ के सभी गुणधर्मों को प्रदर्शित करता है।
• किसी यौगिक का रासायनिक सूत्र उसके सभी संघटक तत्वों तथा संयोग करने वाले सभी तत्वों के परमाणुओं की संख्या को दर्शाता है।
• परमाणुओं का वह पुंज जो आयन की तरह व्यवहार करता है, उसे बहुपरमाणुक आयन कहते हैं। उनके ऊपर एक निश्चित आवेश होता है।
• आण्विक यौगिकों के रासायनिक सूत्र प्रत्येक तत्व की संयोजकता द्वारा निर्धारित होते हैं।
• आयनिक यौगिकों में, प्रत्येक आयन के ऊपर आवेशों की संख्या द्वारा यौगिक के रासायनिक सूत्र ज्ञात करते हैं।
यह भी पढ़ें : क्या हमारे आस-पास के पदार्थ शुद्ध हैं : अध्याय 2
अभ्यास
1. 0.24 g ऑक्सीजन एवं बोरॉन युक्त यौगिक के नमूने में विश्लेषण द्वारा यह पाया गया कि उसमें 0.096 g बोरॉन एवं 0.144 g ऑक्सीजन है। उस यौगिक के प्रतिशत संघटन का भारात्मक रूप में परिकलन कीजिए।
Ans.
कुल भार = 0.24 g
बोरॉन = 0.096 g
ऑक्सीजन = 0.144 g
इसलिए ऑक्सीजन का प्रतिशत = 100 – 40 = 60%
2. 3.0 g कार्बन 8.00 g ऑक्सीजन में जलकर 11.00 g कार्बन डाइऑक्साइड निर्मित करता है। जब 3.00 g कार्बन को 50.00 g ऑक्सीजन में जलाएँगे तो कितने ग्राम कार्बन डाइऑक्साइड का निर्माण होगा? आपका उत्तर रासायनिक संयोजन के किस नियम पर आधारित होगा?
Ans. कार्बन और ऑक्सीजन के बीच होने वाली अभिक्रिया को इस समीकरण द्वारा दिखाया जाता है:
C + O₂ → CO₂
इस रासायनिक समीकरण में उपस्थित कार्बन का द्रव्यमान = 12 g
ऑक्सीजन का द्रव्यमान = 32 g
कार्बन डाइऑक्साइड का द्रव्यमान 12+ 32 = 44 h
तीनों का अनुपात = 12 : 32 : 44 = 3 : 8 : 11
इसका अर्थ यह है कि 3.00 g कार्बन हमेशा 8 g ऑक्सीजन के साथ अभिक्रिया करके 11 g कार्बन डाइऑक्साइड बनायेगा। शेष बचा हुआ ऑक्सीजन अभिक्रिया में इस्तेमाल नहीं होगा। यह रासायनिक संयोजन के स्थिर अनुपात के नियम का पालन करेगा।
3. बहुपरमाणुक आयन क्या होते हैं? उदाहरण दीजिए।
Ans. जिस आयन में दो या दो से अधिक परमाणु शामिल होते हैं उन्हें बहुपरमाणुक आयन कहते हैं। उदाहरण: नाइट्रेट आयन, सल्फेट आयन
4. निम्नलिखित के रासायनिक सूत्र लिखिए :
(a) मैग्नीशियम क्लोराइड
Ans. MgCl₂
(b) कैल्सियम क्लोराइड
Ans. CaCl₂
(c) कॉपर नाइट्रेट
Ans. Cu(NO₃)₂
(d) ऐलुमिनियम क्लोराइड
Ans. AlCl₃
(e) कैल्सियम कार्बोनेट
Ans. CaCO₃
5. निम्नलिखित यौगिकों में विद्यमान तत्वों का नाम दीजिए:
(a) बुझा हुआ चूना
(b) हाइड्रोजन ब्रोमाइड
(c) बेकिंग पाउडर (खाने वाला सोडा)
(d) पोटैशियम सल्फेट
Ans.
| यौगिक | तत्वों के नाम |
| (a) बुझा हुआ चूना Ca(OH)2 | कैल्शियम, ऑक्सीजन और हाइड्रोजन |
| (b) हाइड्रोजन ब्रोमाइड HBr | हाइड्रोजन और ब्रोमीन |
| (c) बेकिंग पाउडर (खाने वाला सोडा) NaHCO3 | सोडियम, कार्बन और हाइड्रोजन |
| (d) पोटैशियम सल्फेट K2SO4 | पोटेशियम, सल्फर और ऑक्सीजन |
6. निम्नलिखित पदार्थों के मोलर द्रव्यमान का परिकलन कीजिए:
(a) एथाइन, C₂H₂
(b) सल्फर अणु, S8
(c) फॉस्फोरस अणु, P4, (फॉस्फोरस का परमाणु द्रव्यमान = 31)
(d) हाइड्रोक्लोरिक अम्ल, HCI
(e) नाइट्रिक अम्ल, HNO₃
Ans.
(a) एथाइन, C2H2
मोलर द्रव्यमान = 2 x 12 + 1 x 2 = 24 + 2 = 26 g
मोलर द्रव्यमान का परिकलन आण्विक द्रव्यमान की तरह ही किया जाता है। अंतर सिर्फ इतना है कि इकाई u को बदलकर g कर देते हैं।
(b) सल्फर अणु, S8
मोलर द्रव्यमान = 8 × 32 = 256 g
(c) फॉस्फोरस अणु, P4
मोलर द्रव्यमान = 4 × 31 = 124g
(d) हाइड्रोक्लोरिक अम्ल, HCl
मोलर द्रव्यमान = 1 × 1 + 35.5 × 1 = 1 + 35.5 = 36.5 g
(e) नाइट्रिक अम्ल, HNO3
मोलर द्रव्यमान
= (H का परमाणु द्रव्यमान) + (N का परमाणु द्रव्यमान) + (3 ऑक्सीजन का परमाणु द्रव्यमान)
= [1 + 14 + 3 × 16] g
= (1 + 14 + 48) g
= 63 gm
7. निम्न का द्रव्यमान क्या होगा|
(a) 1 मोल नाइट्रोजन परमाणु?
(b) 4 मोल ऐलुमिनियम परमाणु (ऐलुमिनियम का परमाणु द्रव्यमान = 27)?
(c) 10 मोल सोडियम सल्फाइट (Na2SO3)?
Ans.
(a) नाइट्रोजन परमाणु (N) का मोलर द्रव्यमान = नाइट्रोजन का परमाणु द्रव्यमान 14g
अतः, 1 मोल नाइट्रोजन परमाणु का द्रव्यमान = 14g
(b) ऐलुमिनियम परमाणु (Al) का मोलर द्रव्यमान ऐलुमिनियम का परमाणु द्रव्यमान = 27g
अतः, 4 मोल ऐलुमिनियम परमाणु का द्रव्यमान = 27× 4 = 108 g
(c) सोडियम सल्फाइट (Na2SO3) का मोलर द्रव्यमान = 23 × 2 + 32 × 1 + 16 × 3
= 46 + 32 + 48
= 126g
अतः, 10 मोल सोडियम सल्फाइट का द्रव्यमान = 10 × 126 = 1260g
पृष्ठ संख्या 30
1. एक अभिक्रिया में 5.3g सोडियम कार्बोनेट एवं 6.0 g एसीटिक अम्ल अभिकृत होते हैं। 2.2g कार्बन डाइऑक्साइड 8.2 g सोडियम एसीटेट एवं 0.9 g जल उत्पाद के रूप में प्राप्त होते हैं। इस अभिक्रिया द्वारा दिखाइए कि यह परीक्षण द्रव्यमान संरक्षण के नियम के अनुरूप है।
सोडियम कार्बोनेट + एसीटिक अम्ल → सोडियम एसीटेट + कार्बन डाइऑक्साइड + जल
Ans. अभिकारकों का द्रव्यमान = सोडियम कार्बोनेट का द्रव्यमान + एसीटिक अम्ल का द्रव्यमान
= 5.3 g + 6.0 g
= 11.3 g …(i)
उत्पादों का द्रव्यमान = सोडियम एसीटेट + कार्बन डाइऑक्साइड + जल
= 8.2 g + 2.2 g + 0.9 g
= 11.3 g …(ii)
समीकरण (i) तथा (ii) से स्पष्ट हो जाता है कि
अभिकारकों का द्रव्यमान = उत्पादों का द्रव्यमानं
अतः परीक्षण द्रव्यमान संरक्षण के नियम के अनुरूप है।
2. हाइड्रोजन एवं ऑक्सीजन द्रव्यमान के अनुसार 1 : 8 के अनुपात में संयोग करके जल निर्मित करते हैं। 3 g हाइड्रोजन गैस के साथ पूर्णरूप से संयोग करने के लिए कितने ऑक्सीजन गैस के द्रव्यमान की आवश्यकता होगी?
Ans. दिया है: हाइड्रोजन : ऑक्सीजन = 1 : 8
1g हाइड्रोजन की सम्पूर्ण अभिक्रिया के लिए जरुरी ऑक्सीजन = 8g
इसलिए, 3g हाइड्रोजन की सम्पूर्ण अभिक्रिया के लिए जरुरी ऑक्सीजन = 8 × 3 = 24g
अतः, 3g हाइड्रोजन गैस के साथ पूर्ण रूप से संयोग करने के लिए 24g ऑक्सीजन गैस के द्रव्यमान की आवश्यकता होगी।
3. डाल्टन के परमाणु सिद्धांत का कौन-सा अभिग्रहीत द्रव्यमान के संरक्षण के नियम का परिणाम है?
Ans. डाल्टन के सिद्धांत का दूसरा अभिग्रहीत द्रव्यमान के संरक्षण नियम का परिणाम है, जो इस प्रकार हैपरमाणु अविभाज्य सूक्ष्मतम कण होते हैं जो रासायनिक अभिक्रिया में न तो सृजित होते हैं, न ही उनका विनाश होता है।
4. डाल्टन के परमाणु सिद्धांत का कौन-सा अभिग्रहीत निश्चित अनुपात के नियम की व्याख्या करता है?
Ans. डाल्टन के परमाणु सिद्धांत का अभिग्रहीत (VI) निश्चित अनुपात के नियम की व्याख्या करता है, जो इस प्रकार है”किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं।”
पृष्ठ संख्या 34
1. परमाणु द्रव्यमान इकाई को परिभाषित कीजिए।
Ans. परमाणु द्रव्यमान इकाई कार्बन -12 समस्थानिक के एक परमाणु के द्रव्यमान के 1/12 वें भाग के बराबर होती है।
2. एक परमाणु को आँखों द्वारा देखना क्यों संभव नहीं होता है?
Ans. परमाणु बहुत छोटे होते हैं। ये किसी भी छोटी वस्तु, जिसकी हम कल्पना या तुलना कर सकते हैं, से भी छोटे होते हैं। इसलिए एक परमाणु को आँखों द्वारा देखना संभव नहीं होता है।
पृष्ठ संख्या 38
1. निम्न के सूत्र लिखिए
(i) सोडियम ऑक्साइड
(ii) ऐलुमिनियम क्लोराइड
(iii) सोडियम सल्फाइड
(iv) मैग्नीशियम हाइड्रॉक्साइड।
Ans.
(i) सोडियम ऑक्साइड – Na2O
(ii) ऐलुमिनियम क्लोराइड – AlCI3
(iii) सोडियम सल्फाइड – Na2S
(iv) मैग्नीशियम हाइड्रॉक्साइड – Mg(OH)2
2. निम्नलिखित सूत्रों द्वारा प्रदर्शित यौगिकों के नाम लिखिए
(i) Al2(SO4)3
(ii) CaCl2
(iii) K2SO4
(iv) KNO3
(v) CaCO3
Ans.
(i) Al2(SO4)3 = ऐलुमिनियम सल्फेट
(ii) CaCl2 = कैल्सियम क्लोराइड
(iii) K2SO4 = पोटैशियम सल्फेट
(iv) KNO3 = पोटैशियम नाइट्रेट
(v) CaCO3 = कैल्सियम कार्बोनेट
3. रासायनिक सूत्र को क्या तात्पर्य है?
Ans. किसी यौगिक का रासायनिक सूत्र उसके संघटक का प्रतीकात्मक निरूपण होता है; जैसे-कार्बन डाइऑक्साइड का रासायनिक सूत्र CO2 है। रासायनिक सूत्र को अणु सूत्र भी कहते हैं।
4. निम्न में कितने परमाणु विद्यमान हैं?
(i) H2S अणु एवं
(ii) आयन?
Ans.
(i) H2S के अणु में 2 हाइड्रोजन परमाणु तथा 1 सल्फर का परमाणु विद्यमान है। अतः इसमें परमाणुओं की कुल संख्या = 3 है।
(ii) PO4 3- आयन में फास्फोरस का 1 परमाणु तथा ऑक्सीजन के 4 परमाणु हैं।
अतः इसमें परमाणुओं की कुल संख्या = 5 है।
पृष्ठ संख्या 39
1. निम्न यौगिकों के आण्विक द्रव्यमान का परिकलन कीजिए H2, O2, Cl2, CO2, CH4, C2H6, C2H4, NH3 एवं CH3OH
Ans. यौगिक का आण्विक द्रव्यमान = यौगिक के एक अणु में उपस्थित सभी परमाणुओं का कुल द्रव्यमान
अतः,
H2 का आण्विक द्रव्यमान = 2 × 1 = 2u
O2 का आण्विक द्रव्यमान = 2 × 16 = 32u
Cl2 का आण्विक द्रव्यमान = 2 × 35.5 = 70u
CO2 का आण्विक द्रव्यमान = 1 × 12 + 2 × 16 = 44 u
CH4 का आण्विक द्रव्यमान = 1 × 12 + 4 × 1 = 16 u
C2H6 का आण्विक द्रव्यमान = 2 × 12 + 6 × 1 = 30 u
C2H4 का आण्विक द्रव्यमान = 2 × 12 + 4 × 1 = 28 u
NH3 का आण्विक द्रव्यमान = 1 × 14 + 3 × 1 = 17 u
CH3OH का आण्विक द्रव्यमान = 1 × 12 + 4 × 1 + 1 × 16 = 32 u
2. निम्न यौगिकों के सूत्र इकाई द्रव्यमान का परिकलन कीजिए|
ZnO, Na2O एवं K2CO3
दिया गया है: Zn का परमाणु द्रव्यमान = 65u, Na का परमाणु द्रव्यमान = 23u, K का परमाणु द्रव्यमान = 39u, C का परमाणु द्रव्यमान = 12u एवं O का परमाणु द्रव्यमान = 16u है।
Ans. (i) ZnO का सूत्र इकाई द्रव्यमान = Zn का परमाणु द्रव्यमान + O का परमाणु द्रव्यमान
= (1 × 65 + 1 × 16)u
= (65 + 16)u
= 81u
(ii) Na2O का सूत्र इकाई द्रव्यमान
= (2 सोडियम की परमाणु द्रव्यमान) + (1 ऑक्सीजन का परमाणु द्रव्यमान)
= (2 × 23 + 1 × 16) u
= (46 + 16) u
= 62u
(iii) K2CO3 का सूत्र इकाई द्रव्यमान
= (2 K का परमाणु द्रव्यमान) + (1 C का परमाणु द्रव्यमान) + (3 O का परमाणु द्रव्यमान)
= (2 × 39 + 1 × 12 + 3 × 16) u
= (78 + 12 + 48) u
= 138u

1 thought on “परमाणु एवं अणु : अध्याय 3”