हम कैसे जान सकते हैं कि बाज़ार से खरीदा हुआ दूध, घी, मक्खन, नमक, मसाला, मिनरल जल या जूस शुद्ध हैं?

क्या आपने कभी इन खाने वाले पदार्थों के डिब्बों के ऊपर लिखे ‘शुद्ध’ शब्द पर ध्यान दिया है? एक साधारण व्यक्ति के लिए शुद्ध का अर्थ होता है कि पदार्थ में कोई मिलावट न हो लेकिन, वैज्ञानिकों के लिए ये सभी वस्तुएँ विभिन्न पदार्थों के मिश्रण हैं, अतः शुद्ध नहीं हैं। उदाहरण के लिए दूध जल, वसा, प्रोटीन आदि का मिश्रण है। जब एक वैज्ञानिक किसी पदार्थ को शुद्ध कहता है तो इसका तात्पर्य है कि उस पदार्थ में मौजूद सभी कण समान रासायनिक प्रकृति के हैं। एक शुद्ध पदार्थ एक ही प्रकार के कणों से मिलकर बना होता है।
जब हम अपने चारों ओर देखते हैं तो पाते हैं कि सभी पदार्थ दो या दो से अधिक शुद्ध अवयवों के मिलने से बने हैं, उदाहरण के लिए, समुद्र का जल. खनिज, मिट्टी आदि सभी मिश्रण हैं।
2.1 मिश्रण क्या है?
मिश्रण एक या एक से अधिक शुद्ध तत्वों या यौगिकों से मिलकर बना होता है। हम जानते हैं कि जल में घुले हुए सोडियम क्लोराइड को वाष्पीकरण या आसवन विधि द्वारा जल से पृथक् किया जा सकता है। यद्यपि, सोडियम क्लोराइड अपने आप में एक शुद्ध पदार्थ है और इसे भौतिक विधि के द्वारा इसके रासायनिक अवयवों में पृथक् नहीं किया जा सकता है। इसी प्रकार चीनी एक पदार्थ है क्योंकि यह एक ही प्रकार का शुद्ध अवयव रखता है और इसका यौगिक समान रहता है।
पेय पदार्थ और मिट्टी में एकसमान कण नहीं होते हैं। शुद्ध पदार्थ किसी भी स्रोत से प्राप्त हो इसके अभिलाक्षणिक गुण एकसमान होंगे।
इस प्रकार हम कह सकतें हैं कि मिश्रण में एक से अधिक शुद्ध पदार्थ होते हैं।
2.1.1 मिश्रण के प्रकार
अवयवों की प्रकृति के अनुसार विभिन्न प्रकार के मिश्रणों का निर्माण होता है। इस तरह मिश्रण के कई प्रकार होते हैं।
क्रियाकलाप 2.1
• कक्षा को अ, ब, स और द समूहों में बाँटें।
• एक बीकर जिसमें 50mL जल और एक चम्मच कॉपर सल्फेट चूर्ण हो, समूह ‘अ’ को दें।
• समूह ‘ब’ को एक बीकर में 50mL जल तथा दो चम्मच कॉपर सल्फेट चूर्ण दें।
• कॉपर सल्फेट और पोटैशियम परमैगनेट या साधारण नमक (सोडियम क्लोराइड) समूह ‘स’ और ‘द’ को दें। (दोनों को अवयवों की पृथक् पृथक् मात्रा दें)।
• अब पृथक् पृथक् समूह के उन अवयवों को मिलाकर मिश्रण तैयार करें।
• उनके रंग और बनावट के आधार पर एक रिर्पोट तैयार करें।
• समूह ‘अ’ और ‘ब’ को एक मिश्रण प्राप्त होता है जिसकी बनावट समान होती है। इस तरह के मिश्रण को हम समांगी मिश्रण अथवा विलयन कहते हैं। इस तरह के मिश्रणों के कुछ अन्य उदाहरण हैं, जल में नमक और जल में चीनी। दोनों समूहों से प्राप्त घोल के रंगों की तुलना करें। यद्यपि दोनों समूह के पास कॉपर सल्फेट का घोल है, लेकिन उन दोनों घोल के रंगों की तीव्रता पृथक् पृथक् है। यह दिखलाता है कि समांगी मिश्रण पृथक् पृथक् संघटन रख सकते हैं।
• समूह ‘स’ और ‘द’ ने जो मिश्रण प्राप्त किया है, उनके अंश भौतिक दृष्टि से पृथक् हैं। इस तरह के मिश्रण को विषमांगी मिश्रण कहते हैं। सोडियम क्लोराइड और लोहे की छीलन, नमक और सल्फर एवं जल और तेल विषमांगी मिश्रण के अन्य उदाहरण हैं।
क्रियाकलाप 2.2
• आइए पुनः कक्षा को चार समूहों अ, ब, स और द में बाँटें।
• प्रत्येक समूह को नीचे दिए हुए नमूने में से एक दें:
समूह ‘अ’ को कॉपर सल्फेट के कुछ क्रिस्टल दें।
समूह ‘ब’ को एक चम्मच कॉपर सल्फेट दें।
समूह ‘स’ को चॉक का चूर्ण या गेहूँ का आटा दें।
समूह ‘द’ को दूध या स्याही की कुछ बूँदें दें।
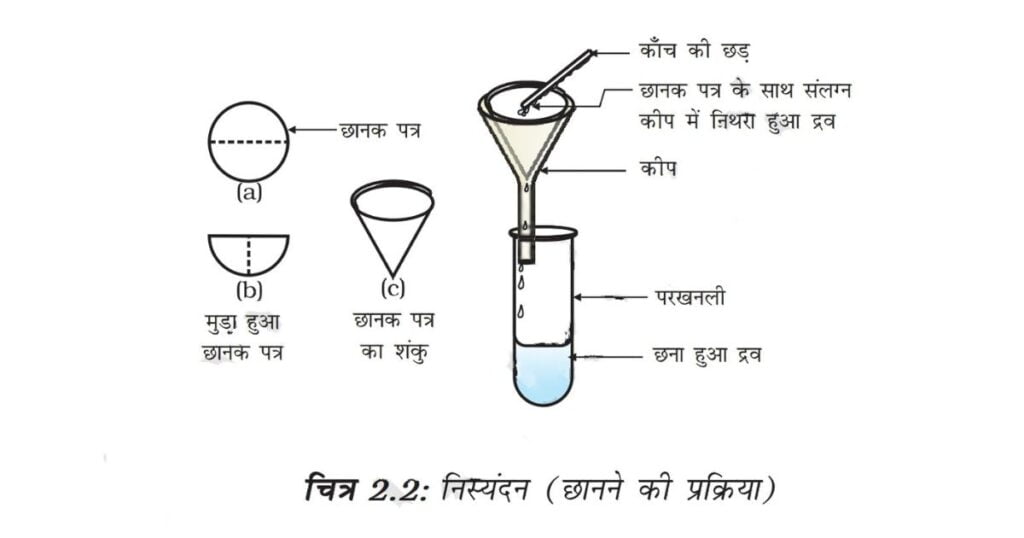
• छात्रों को काँच की छड़ की सहायता से नमूनों को जल में मिलाने को कहें। क्या कण जल में दिखाई देते हैं?
• अब टॉर्च से प्रकाश की किरण को बीकर पर डालें और इसको सामने से देखें। क्या प्रकाश की किरण का मार्ग दिखाई देता है?
• अब मिश्रण को कुछ समय तक शांत छोड़ दें। इस बीच मिश्रण छानने वाले उपकरण को तैयार कर लें। क्या मिश्रण स्थिर है या कुछ समय के बाद कण नीचे बैठना शुरू करते हैं?
• मिश्रण को छान लें। क्या छानक पत्र पर कुछ शेष बचा है?
• कक्षा में परिणामों पर चर्चा कर इस क्रिया पर एक मत बनाने का प्रयत्न करें।
• समूह ‘अ’ और ‘ब’ एक विलयन पाते हैं।
• समूह ‘स’ एक निलंबन पाता है।
• समूह ‘द’ एक कोलाइड विलयन पाता है।
2.2 विलयन क्या है?
विलयन दो या दो से अधिक पदार्थों का समांगी मिश्रण है। आप प्रतिदिन बहुत प्रकार के विलयनों को देखते होंगे। नींबू जल, सोडा जल आदि विलयन के उदाहरण हैं। प्रायः हम एक विलयन को ऐसे तरल पदार्थ के रूप में विचार करते हैं जिसमें ठोस, द्रव या गैस मिले हों लेकिन प्रकृति में ठोस विलयन (मिश्र धातु) और गैसीय विलयन (वायु) भी होते हैं। एक विलयन के कणों में समांगिकता होती है। उदाहरण के लिए नींबू जल का स्वाद सदैव समान रहता है। यह दर्शाता है कि इस विलयन में चीनी और नमक के कण समान रूप से वितरित होते हैं।
किसी विलयन को दो भागों विलायक और विलय में बाँटा जाता है। विलयन का वह घटक (जिनकी मात्रा दूसरे से अधिक होती है) जो दूसरे घटक को विलयन में मिलाता है उसे विलायक कहते हैं। विलयन का वह घटक (प्रायः कम मात्रा में होता है) जो कि विलायक में घुला होता है उसे विलेय कहते हैं।
उदाहरण के लिए :
(i) चीनी और जल का विलयन एक तरल घोल में ठोस का उदाहरण है। इसमें चीनी विलेय है और जल विलायक है।
(ii) आयोडिन और ऐल्कोहॉल का विलयन जिसे टिंक्चर आयोडीन के नाम से जाना जाता है, इसमें आयोडीन विलेय है और ऐल्कोहॉल विलायक है।
(iii) वातयुक्त पेय जैसे सोडा जल, कोक इत्यादि तरल विलयन में गैस के रूप में हैं। इनमें कार्बन डाइऑक्साइड गैस विलेय और जल विलायक है।
(iv) वायु गैस में गैस का विलयन है। यह मुख्यतः दो घटकों ऑक्सीजन (21%) और नाइट्रोजन (78%) का समांगी मिश्रण है। नाइट्रोजन को वायु का विलायक कहा जाता है। वायु में दूसरी गैसें बहुत कम मात्रा में उपलब्ध होती हैं।
विलयन के गुण
• विलयन एक समांगी मिश्रण है।
• विलयन के कण व्यास में 1 nm (10 meter) से भी छोटे होते हैं। इसलिए वे आँख से नहीं देखे जा सकते हैं। I
• अपने छोटे आकार के कारण विलयन के कण, गुजर रही प्रकाश की किरण को फैलाते नहीं हैं। इसलिए विलयन में प्रकाश का मार्ग दिखाई नहीं देता।
• छानने की विधि द्वारा विलेय के कणों को विलयन में से पृथक् नहीं किया जा सकता है। विलयन को शांत छोड़ देने पर भी विलेय के कण नीचे नहीं बैठते हैं, अर्थात् विलयन स्थाई है।
मिश्र धातुएँ: ये धातुओं के समांगी मिश्रण होते हैं जिन्हें भौतिक क्रिया द्वारा अवयवों में पृथक् नहीं किया जा सकता है लेकिन फिर भी मिश्र धातुओं को मिश्रण माना जाता है क्योंकि ये अपने घटकों के गुणों को दर्शाते हैं और पृथक् पृथक संघटन रखते हैं। उदाहरण के लिए पीतल, जिंक (लगभग 30%) और कॉपर (लगभग 70%) का मिश्रण है।
2.2.1 विलयन की सांद्रता
क्रियाकलाप 2.2 में हमने देखा कि समूह ‘अ’ और समूह ‘ब’ के पास एक ही पदार्थ के विभिन्न आभाओं के रंगों के विलयन हैं। हम लोग जानते हैं कि विलयन में पृथक् पृथक् मात्रा में विलायक और विलेय पदार्थ होते हैं। विलयन में मौजूद विलेय पदार्थ की मात्रा के आधार पर इसे तनु, सांद्र या संतृप्त घोल कहा जा सकता है। तनु और सांद्र तुलनात्मक शब्द हैं। क्रियाकलाप 2.2 में समूह ‘अ’ द्वारा प्राप्त विलयन समूह ‘ब’ की तुलना में तनु है।
क्रियाकलाप 2.3
• दो पृथक् पृथक् बीकरों में 50 mL जल लें।
• एक बीकर में नमक और दूसरे में चीनी अथवा बेरियम क्लोराइड मिलाकर अच्छी तरह मिला लें।
• जब विलेय पदार्थ और अधिक न घुले तब 5°C ताप बढ़ाने के लिए बीकर को गर्म करें।
• विलेय पदार्थ को पुनः मिलाना शुरू करें।
क्या किसी दिए गए ताप पर चीनी, नमक अथवा बेरियम क्लोराइड की जल में घोली गई मात्राएँ बराबर हैं?
किसी निश्चित तापमान पर उतना ही विलेय पदार्थ घुल सकता है जितनी कि विलयन की क्षमता होती है। दूसरे शब्दों में, दिए गए निश्चित तापमान पर यदि विलयन में विलेय पदार्थ नहीं घुलता है तो उसे संतृप्त विलयन कहते हैं। विलेय पदार्थ की वह मात्रा, जो इस ताप पर संतृप्त विलयन में उपस्थित है, उसकी घुलनशीलता कहलाती है।
यदि एक विलयन में विलेय पदार्थ की मात्रा संतृप्तता से कम है तो इसे असंतृप्त विलयन कहा जाता है।
यदि विलयन में विलेय पदार्थ की सांद्रता संतृप्त स्तर से कम हो तो उसे असंतृप्त विलयन कहते हैं।
यदि आप किसी विशिष्ट ताप पर एक संतृप्त विलयन लें तथा उसे धीरे-धीरे ठंडा करें तो क्या होगा?
उपरोक्त किए गए क्रियाकलाप से हम कह सकते हैं कि दिए हुए एक निश्चित तापमान पर पृथक् पृथक् पदार्थों की विलयन क्षमता भिन्न होती है।
विलायक की मात्रा (द्रव्यमान अथवा आयतन) में घुले हुए विलेय पदार्थ की मात्रा को विलयन की सांद्रता कहते हैं।
विलयन की सांद्रता को दर्शाने की बहुत सी विधियाँ हैं, लेकिन हम यहाँ सिर्फ़ तीन विधियों के बारे में चर्चा करेंगे।
(i) द्रव्यमान/विलयन के द्रव्यमान प्रतिशत = विलेय पदार्थ का द्रव्यमान /विलयन का द्रव्यमान ×100
(ii) द्रव्यमान/विलयन के आयतन प्रतिशत = विलेय पदार्थ का द्रव्यमान /विलयन का आयतन ×100
(iii) विलयन के आयतन/आयतन प्रतिशत = विलेय का आयतन/विलयन का आयतन × 100
उदाहरण 2.1 एक विलयन के 320g विलायक जल में 40 g साधारण नमक विलेय है। विलयन की सांद्रता का परिकलन करें।
हल:
विलेय पदार्थ (नमक) का द्रव्यमान = 40 g
विलायक (जल) का द्रव्यमान = 320 g
हम जानते हैं,
विलयन का द्रव्यमान = विलेय पदार्थ का द्रव्यमान + विलायक का द्रव्यमान = 40 g + 320 g = 360 g
विलयन का द्रव्यमान प्रतिशत = विलेय पदार्थ का द्रव्यमान / विलयन का द्रव्यमान ×100
= 40 /360 × 100 = 11.1%
2.2.2 निलंबन क्या है?
क्रियाकलाप 2.2 में समूह ‘स’ के द्वारा पाया गया विषमांगी घोल जो ठोस द्रव में परिक्षेपित हो जाता है, निलंबन कहलाता है। निलंबन एक विषमांगी मिश्रण है, जिसमें विलेय पदार्थ कण घुलते नहीं हैं बल्कि माध्यम की समष्टि में निलंबित रहते हैं। ये निलंबित कण आँखों से देखे जा सकते हैं।
निलंबन के गुणधर्म
• यह एक विषमांगी मिश्रण है।
• ये कण आँखों से देखे जा सकते हैं।
• ये निलंबित कण प्रकाश की किरण को फैला देते हैं, जिससे उसका मार्ग दृष्टिगोचर हो जाता है।
• जब इसे शांत छोड़ देते हैं तब ये कण नीचे की ओर बैठ जाते हैं अर्थात निलंबन अस्थायी होता है। छानन विधि द्वारा इन कणों को मिश्रण से पृथक् किया जा सकता है।
जब सभी कण नीचे बैठ जाते हैं तो निलंबन समाप्त हो जाता है तथा विलयन में प्रकाश की किरण का प्रकीर्णन रुक जाता है।
2.2.3 कोलाइडल विलयन क्या है?
क्रियाकलाप 2.2 में समूह ‘द’ के द्वारा प्राप्त मिश्रण को कोलाइड या कोलाइडल विलयन कहा जाता है। कोलाइड के कण विलयन में समान रूप से फैले होते हैं। निलंबन की अपेक्षा कणों का आकार छोटा होने के कारण यह मिश्रण समांगी प्रतीत होता है लेकिन वास्तविकता में विलयन विषमांगी मिश्रण है, जैसे दूध।
सारणी 2.1: कोलाइड्स के सामान्य उदाहरण
| परिक्षिप्त प्रावस्था | परिक्षेपन माध्यम | प्रकार | उदाहरण |
| द्रव | गैस | एरोसोल | कोहरा, बादल, कुहासा |
| ठोस | गैस | एरोसोल | धुंआ, स्वचालित वाहन का निथार |
| गैस | द्रव | फोम | शेविंग क्रीम |
| द्रव | द्रव | इमलशन | दूध, फ्रेश क्रीम |
| ठोस | द्रव | सोल | मैग्नेशिया मिल्क, कीचड़ |
| गैस | ठोस | फोम | फोम, रबड़, स्पंज, प्युमिस |
| द्रव | ठोस | जैल | जेली, पनीर, मक्खन |
| ठोस | ठोस | ठोस सोल | रंगीन रत्न पत्थर, दूधिया कांच |
कोलाइडल कणों के छोटे आकार के कारण हम इसे आँख से नहीं देख पाते हैं लेकिन ये कण प्रकाश की किरण को आसानी से फैला देते हैं, जैसा कि हमने क्रियाकलाप 2.2 में देखा है। प्रकाश की किरण का फैलाना टिनडल प्रभाव (Tyndall effect) कहा जाता है। टिनडल नामक वैज्ञानिक ने इसकी खोज की थी। एक कमरे में छोटे छिद्र के द्वारा जब प्रकाश की किरण आती है तब वहाँ पर हम टिनडल प्रभाव को देख सकते हैं। यह कमरे में मौजूद धूल और कार्बन के कणों के द्वारा प्रकाश के फैलने के कारण होता है।
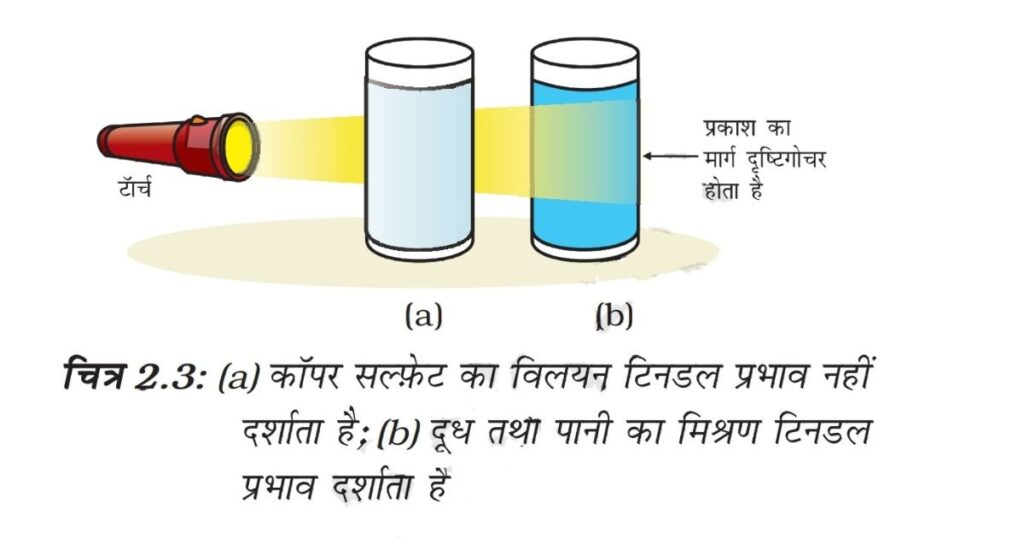
जब एक घने जंगल के आच्छादन से सूर्य की किरण गुजरती है वहाँ हम टिनडल प्रभाव को देख सकते हैं। जंगल के कोहरे में छोटे-छोटे जल के कण होते हैं जो कि कोलाइड कणों के समान व्यवहार करते हैं।

कोलाइड के गुणधर्म
• यह एक विषमांगी मिश्रण है।
• कोलाइड के कणों का आकार इतना छोटा होता है कि ये पृथक् रूप में आँखों से नहीं देखे जा सकते हैं।
• ये इतने बड़े होते हैं कि प्रकाश की किरण को फैलाते हैं तथा उसके मार्ग को दृश्य बनाते हैं।
• जब इनको शांत छोड़ दिया जाता है तब ये कण तल पर बैठते हैं अर्थात् ये स्थायी होते हैं।
• ये छानन विधि द्वारा मिश्रण से पृथक् नहीं किए जा सकते। किंतु एक विशेष विधि अपकेंद्रीकरण तकनीक (क्रियाकलाप 2.5) द्वारा पथक् किए जा सकते हैं।
कोलाइडल विलयन परिक्षिप्त प्रावस्था और परिक्षेपण माध्यम से बनता है। विलेय पदार्थ की तरह का घटक या परिक्षिप्त कण जो कि कोलाइडल रूप में रहता है उसे परिक्षिप्त प्रावस्था (dispersed phase) कहते हैं तथा वह घटक जिसमें परिक्षिप्त प्रावस्था निलंबित रहता है, उसे परिक्षेपण माध्यम (dispersing medium) कहते हैं। कोलाइडल को परिक्षेपण माध्यम (ठोस, द्रव या गैस) की अवस्था और परिक्षिप्त प्रावस्था के अनुसार वर्गीकृत किया जाता है। सारणी 2.1 में कुछ उदाहरण दिए गए हैं।
2.3 भौतिक एवं रासायनिक परिवर्तन
पिछले अध्याय में हमने पदार्थ के भौतिक गुणों के बारे में अध्ययन किया है। ऐसे गुण जिनका हम अवलोकन एवं वर्णन कर सकते हैं, जैसे कि रंग, कठोरता, दृढ़ता, बहाव, घनत्व, द्रवनांक तथा क्वथनांक इत्यादि को भौतिक गुण कहा जाता है।
अवस्थाओं का अंत: रूपांतरण एक भौतिक परिवर्तन है क्योंकि ये परिवर्तन पदार्थों के संघटन में बिना परिवर्तन किए होते हैं और उनकी रासायनिक प्रकृति में भी कोई परिवर्तन नहीं होता है। यद्यपि बर्फ़ जल और वाष्प अलग-अलग दिखते हैं और ये भिन्न-भिन्न भौतिक गुणों को दर्शाते हैं लेकिन ये रासायनिक रूप से समान होते हैं।
जल तथा खाना पकाने वाले तेल दोनों द्रव हैं, लेकिन इनके रासायनिक गुणधर्म भिन्न हैं। इनकी गंध और ज्वलनशीलता में अंतर है। हम जानते हैं कि तेल हवा में जलता है, जबकि जल आग को बुझाता है। तेल का यह रासायनिक गुण जल से इसे अलग करता है। जलना एक रासायनिक परिवर्तन है। जलने की प्रक्रिया में एक पदार्थ दूसरे से क्रिया करके अपने रासायनिक संघटन में परिवर्तन लाता है। रासायनिक परिवर्तन पदार्थ के रासायनिक गुणधर्मों में परिवर्तन लाता है तथा हम नया पदार्थ पाते हैं। रासायनिक परिवर्तन को रासायनिक प्रतिक्रिया भी कहा जाता है।
मोमबत्ती के जलने की प्रक्रिया में भौतिक एवं रासायनिक दोनों परिवर्तन होते हैं। क्या आप इनकी पहचान कर सकते हैं?
2.4 शुद्ध पदार्थों के क्या प्रकार है?
पदार्थों को उनके रासायनिक संघटन के आधार पर तत्वों या यौगिकों में वर्गीकृत किया जा सकता है।
2.4.1 तत्व
रॉबर्ट बायल पहले वैज्ञानिक थे, जिन्होंने सन् 1661 में सर्वप्रथम तत्व शब्द का प्रयोग किया। फ्रांस के रसायनज्ञ एंटोनी लॉरेंट लवाइजिए (सन् 1743- सन् 1794) ने सबसे पहले तत्व की परिभाषा को प्रयोग द्वारा प्रतिपादित किया। उनके अनुसार तत्व पदार्थ का वह मूल रूप है जिसे रासायनिक प्रतिक्रिया द्वारा अन्य सरल पदार्थों में विभाजित नहीं किया जा सकता।
तत्वों को साधारणतया धातु, अधातु तथा उपधातु में वर्गीकृत किया जा सकता है।
धातुएँ प्रायः दिए हुए निम्न गुणधर्मों में से सभी को या कुछ को प्रदर्शित करती हैं।
• ये चमकीली होती हैं।
• ये चाँदी जैसी सफेद या सोने की तरह पीले रंग की होती हैं।
• ये ताप तथा विद्युत की सुचालक होती हैं।
• ये तन्य होती हैं (और इनको तार के रूप में खींचा जा सकता है)।
• ये आघातवर्ध्य होती हैं। इनको पीटकर महीन चादरों में ढाला जा सकता है।
• ये प्रतिध्वनिपूर्ण होती हैं।
सोना, चाँदी, ताँबा, लोहा, सोडियम, पोटैशियम इत्यादि धातु के उदाहरण हैं। पारा धातु होते हुए भी कमरे के तापमान पर द्रव है।
अधातुएँ दिए गए निम्न गुणों में से प्रायः कुछ को या सभी को प्रदर्शित करती हैं:
• ये विभिन्न रंगों की होती हैं।
• ये ताप और विद्युत की कुचालक होती हैं।
• ये चमकीली, प्रतिध्वनिपूर्ण और आघातवर्ध्य नहीं होती हैं।
हाइड्रोजन, ऑक्सीजन, आयोडीन, कार्बन, (कोल, कोक), ब्रोमीन, क्लोरीन इत्यादि अधातुओं के उदाहरण हैं। कुछ तत्व धातु और अधातु के बीच के गुणों को दर्शाते हैं, जिन्हें उपधातु (metalloid) कहा जाता है, जैसे बोरान, सिलिकन, जर्मेनियम इत्यादि।
2.4.2 यौगिक
एक यौगिक वह पदार्थ है जो कि दो या दो से अधिक तत्वों के नियत अनुपात में रासायनिक तौर पर संयोजन से बना है।
जब दो या दो से अधिक तत्व आपस में मिलते हैं तो हम क्या पाते हैं?
क्रियाकलाप 2.4
• कक्षा को दो समूहों में विभक्त करें। दोनों समूहों को 50 g लोहे का चूर्ण और 3 g सल्फर, एक चीनी मिट्टी की प्याली में दें।
समूह ।
• लोहे के चूर्ण और सल्फर पाउडर को पीसकर मिलाएँ।
समूह ।।
• लोहे के चूर्ण और सल्फ़र पाउडर को पीसकर मिलाएँ। मिश्रण को तीव्र ताप पर लाल होने तक गर्म करें। अब ज्वाला को हटा दें तथा मिश्रण को ठंडा होने दें।
समूह I और II
• प्राप्त सामग्री में चुंबकीय गुण की जाँच करें। सामाग्री के निकट एक चुंबक को लाएँ। जाँच करें कि क्या सामग्री चुंबक की ओर आकर्षित होती है?
• दोनों समूहों द्वारा प्राप्त सामग्री के रंग और बनावट की तुलना करें।
• प्राप्त सामग्री के एक भाग में कार्बन डाइसल्फाइड मिलाएँ। मिश्रण अच्छी तरह मिलाएँ तथा छान लें।
• प्राप्त पदार्थ के दूसरे भाग में तनु सल्फ्यूरिक अम्ल या तनु हाइड्रोक्लोरिक अम्ल को मिलाएँ। (इस क्रियाकलाप के लिए अध्यापक का निर्देशन आवश्यक है।)
• इस क्रियाकलाप को लोहा तथा सल्फर तत्वों के साथ अलग-अलग दोहराएँ। अवलोकनों को नोट करें।
• समूह I द्वारा प्राप्त गैस हाइड्रोजन है। यह रंगहीन, गंधहीन और ज्वलनशील है। इसकी ज्वलनशीलता की जाँच कक्षा में न करें।
• समूह II द्वारा प्राप्त गैस हाइड्रोजन सल्फाइड है। यह रंगहीन गैस है और इसकी गंध सड़े हुए अंडे जैसी है।
आपने पाया कि दोनों समूहों द्वारा प्राप्त पदार्थ भिन्न गुणों को दर्शाते हैं। यद्यपि प्रारंभ में दिए गए पदार्थ समान थे, समूह 1 की क्रिया के फलस्वरूप भौतिक परिवर्तन हुआ जबकि समूह II की क्रिया के फलस्वरूप पदार्थों में रासायनिक परिवर्तन हुआ।
• समूह I द्वारा प्राप्त सामग्री दो पदार्थों का मिश्रण है। दिए गए पदार्थ लोहा तथा सल्फ़र हैं।
• मिश्रण का गुण उन दोनों मिले हुए तत्वों के गुण के समान है।
• समूह II द्वारा प्राप्त सामग्री यौगिक है।
सारणी 2.2: मिश्रण तथा यौगिक
| मिश्रण | यौगिक |
| 1. तत्व या यौगिक केवल मिश्रण बनाने के लिए मिलते हैं। किंतु किसी नए यौगिक का निर्माण नहीं करते। | 1. तत्व क्रिया करके नए यौगिक का निर्माण करते हैं। |
| 2. मिश्रण का संघटन परवर्तनीय होता है। | 2. नए पदार्थ का संघटन सदैव स्थायी होता है। |
| 3. मिश्रण उसमें उपस्थित घटकों के गुणधर्मो को दर्शाता है। | 3. नए पदार्थ के गुणधर्म पूरी तरह से भिन्न होते हैं। |
| 4. घटकों को भौतिक विधियों द्वारा सुगमता से पृथक् किया जा सकता है। | 4. घटकों को केवल रासायनिक या वैद्युत रासायनिक प्रतिक्रिया द्वारा ही पृथक् किया जा सकता है। |
• दोनों तत्वों को तीव्रता से गर्म करने पर हमने यौगिक पाया, जिसका गुण मिले हुए तत्वों से पूरी तरह भिन्न है।
• यौगिक का संघटन पूरे पदार्थ में समान है। हम यह भी देख सकते हैं कि यौगिक की बनावट और रंग भी सभी स्थानों पर समान है।
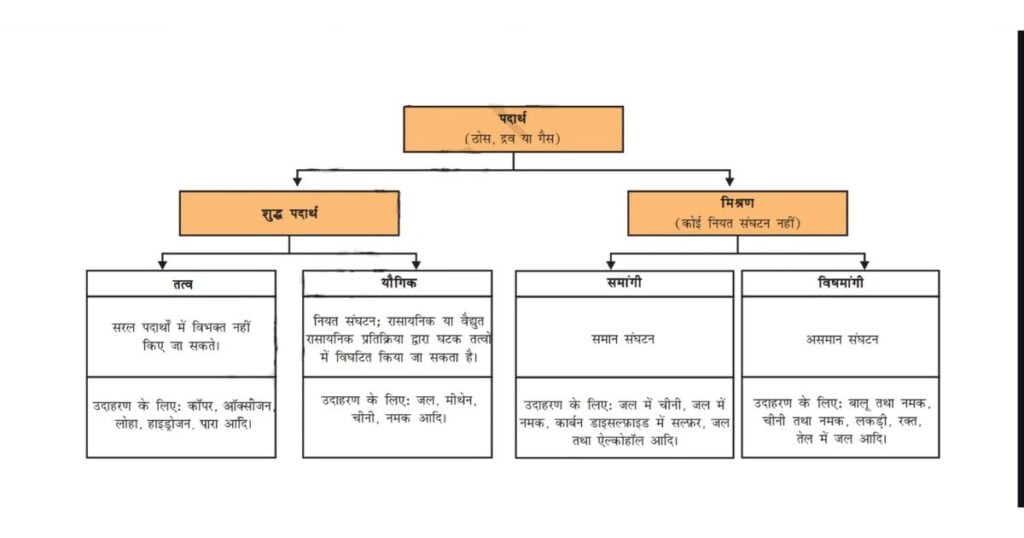
इस प्रकार संक्षेप में हम पदार्थ की भौतिक और रासायनिक प्रकृति को निम्न आरेख द्वारा व्यवस्थित कर सकते हैं।
आपने क्या सीखा
• मिश्रण में एक से अधिक पदार्थ (तत्व तथा/अथवा यौगिक) किसी भी अनुपात में मिले होते हैं।
• मिश्रणों को पृथक् करने के लिए उचित विधियों से शुद्ध पदार्थों में पृथक्करण किया जा सकता है।
• विलयन दो या दो से अधिक पदार्थों का समांगी मिश्रण है। विलयन के बड़े अवयव को विलायक कहते हैं तथा अवयव को विलेय कहते हैं।
• विलयन की सांद्रता उसके इकाई आयतन में उपस्थित विलेय का द्रव्यमान अथवा आयतन है।
• वह पदार्थ जो विलायक में अघुलनशील तथा आँखों से देखा जा सकता है, निलंबन कहलाता है। निलंबन एक विषमांगी मिश्रण होता है।
• कोलाइड एक विषमांगी मिश्रण है, जिसके कणों का आकार इतना छोटा है कि उन्हें सरलता से देखा नहीं जा सकता, किंतु इतना बड़ा है कि ये प्रकाश का फैलाव कर सकने में सक्षम होते हैं। कोलाइड उद्योगों में तथा दैनिक जीवन में महत्वपूर्ण है। विलेय कणों को परिक्षिप्त प्रावस्था कहते हैं और विलायक जिसमें ये पूरी तरह से वितरित रहते हैं, उसे परिक्षेपण माध्यम कहते हैं।
• शुद्ध पदार्थ तत्व या यौगिक हो सकते हैं। तत्व पदार्थ का मूल रूप होता है, जिसे रासायनिक क्रिया द्वारा सरल पदार्थों में विभाजित नहीं किया जा सकता है। यौगिक वह पदार्थ है जो दो या दो से अधिक तत्वों के स्थिर अनुपात में रासायनिक रूप में संयोजन से निर्मित होता है।
• यौगिकों के गुण उसमें निहित तत्वों के गुणों से भिन्न होते हैं, जबकि मिश्रण में उपस्थित तत्व और यौगिक अपने-अपने गुणों को दर्शाते हैं।
यह भी पढ़ें : हमारे आस-पास के पदार्थ : अध्याय 1
अभ्यास
1. निम्नलिखित को पृथक् करने के लिए आप किन विधियों को अपनाएँगे?
(a) सोडियम क्लोराइड को जल के विलयन से पृथक् करने में।
Ans. वाष्पन या वाष्पीकरण विधि
(b) अमोनियम क्लोराइड को सोडियम क्लोराइड तथा अमोनियम क्लोराइड के मिश्रण से पृथक् करने में।
Ans. ऊर्ध्वपातन
(c) धातु के छोटे टुकड़े को कार के इंजन आयॅल से पृथक् करने में।
Ans. निस्पंदन या छानन विधि
(d) दही से मक्खन निकालने के लिए।
Ans. अपकेंद्रण विधि
(e) जल से तेल निकालने के लिए।
Ans. पृथक्करण कीप विधि
(f) चाय से चाय की पत्तियों को पृथक् करने में।
Ans. छानन विधि
(g) बालू से लोहे की पिनों को पृथक् करने में।
Ans. चुंबकीय पृथक्करण विधि
(h) भूसे से गेहूँ के दानों को पृथक् करने में।
Ans. फटकन विधि
(i) पानी में तैरते हुए महीन मिट्टी के कण को पानी से अलग करने के लिए।
Ans. छानकर
(j) पुष्प की पंखुड़ियों के निचोड़ से विभिन्न रंजकों को पृथक् करने में।
Ans. क्रोमैटोग्राफी
2. चाय तैयार करने के लिए आप किन-किन चरणों का प्रयोग करेंगे। विलयन, विलायक, विलेय, घुलना, घुलनशील, अघुलनशील, घुलेय (फ़िल्ट्रेट) तथा अवशेष शब्दों का प्रयोग करें।
Ans.
1. सर्वप्रथम एक पात्र में एक कप पानी विलायक के रूप में लीजिए।
2. इसमें चीनी डालिए जो एक विलेय पदार्थ है।
3. आपको जल तथा चीनी का विलयन प्राप्त होगा क्योंकि चीनी जल में घुलनशील है।
4. अब इसमें एक या आधा चम्मच चाय की पत्ती डालिए जो जल में एक अघुलनशील विलेय है। तथा इसे उबालिए।
5. इसमें एक कप दूध डालकर लगभग 5 मिनट तक पुनः उबालिए।
6. अब एक छननी (Strainer) से इसे छानिए। आपको चाय घुलेय (Filtrate) तथा चाय की पत्तियों छननी के ऊपर अवशेष के रूप में प्राप्त होंगी।
3. प्रज्ञा ने तीन अलग-अलग पदार्थों की घुलनशीलताओं को विभिन्न तापमान पर जाँचा तथा नीचे दिए गए आँकड़ों को प्राप्त किया। प्राप्त हुए परिणामों को 100 gm जल में विलेय पदार्थ की मात्रा, जो संतृप्त विलयन बनाने हेतु पर्याप्त है, निम्नलिखित तालिका में दर्शाया गया है।
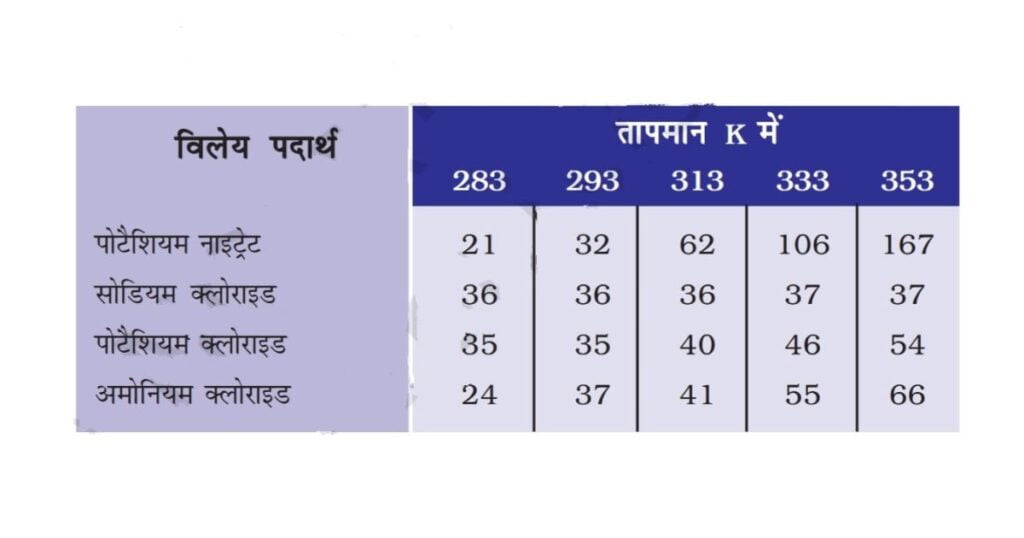
(a) 50 gm जल में 313K पर पोटैशियम नाइट्रेट के संतृप्त विलयन को प्राप्त करने हेतु कितने ग्राम पोटैशियम नाइट्रेट की आवश्यकता होगी?
Ans. चूंकि 100gm जल में 313 K ताप पर पोटेशियम नाइट्रेट (KNO₃) का संतप्त विलयन प्राप्त करने हेतु इसकी मात्रा = 62gm
इसलिए, 50g जल में 313 K ताप पर (KNO₃), की मात्रा 62/100×50 = 31gm
अतः 50 ग्राम जल में 313 केल्विन पर पोटेशियम नाइट्रेट के संतृप्त विलयन को प्राप्त करने हेतु 31 ग्राम पोटेशियम नाइट्रेट की आवश्यकता होगी।
(b) प्रज्ञा 353 K पर पोटैशियम क्लोराइड का एक संतृप्त विलयन तैयार करती है और विलयन को कमरे के तापमान पर ठंडा होने के लिए छोड़ देती है। जब विलयन ठंडा होगा तो वह क्या अवलोकित करेगी? स्पष्ट करें।
Ans. ठंडा होने पर पोटेशियम क्लोराइड की घुलनशीलता कम हो जाएगी जिससे पोटेशियम क्लोराइड ठोस कणों के रूप में आ जाएगा। अतः ठंडे विलयन में पोटेशियम क्लोराइड के शुद्ध क्रिस्टल दिखाई देंगे।
(c) 293 K पर प्रत्येक लवण की घुलनशीलता का परिकलन करें। इस तापमान पर कौन-सा लवण सबसे अधिक घुलनशील होगा?
Ans. 293 K पर प्रत्येक लवण की घुतनशीर्तता इस प्रकार है:
(i) पोटेशियम नाइट्रेट = 32 g
(ii) सोडियम क्लोराइड = 36 g
(iii) पोटेशियम क्लोराइड = 350g
(iv) अमोनियम क्लोराइड = 37 g
(d) तापमान में परिवर्तन से लवण की घुलनशीलता पर क्या प्रभाव पड़ता है?
Ans. ताप में वृद्धि होने पर किसी लवण की घुलनशीलता बढ़ती है तथा ताप में कमी होने पर घुलनशीलता घटती है।
4. निम्न की उदाहरण सहित व्याख्या करें:
(a) संतृप्त विलयन
(b) शुद्ध पदार्थ
(c) कोलाइड
(d) निलंबन
Ans. (a) संतृप्त विलयन (Saturated Solution): जब किसी दिए गए ताप पर किसी विलेय की और अधिक मात्रा उस विलायक में नहीं घुल सकती तो उस विलयन को संतृप्त विलयन कहा जाता है।
उदाहरण: 20 डिग्री तापमान पर 100ml पानी पर सिर्फ 200gm चीनी ही घोली जा सकती है।
(b) शुद्ध पदार्थ (Pure Substance): शुद्ध पदार्थ वह है जो एक ही प्रकार के कणों से मिलकर बना होता है तथा उसमें मौजूद सभी कण समान रासायनिक प्रकृति के होते हैं, जैसे-सोना, बाँदी आदि।
(c) कोलाइड (Collaid): कोलाइड विलयन वे हैं, जिनमें विलेय के कणों का आकार विलयन से बड़े परंतु निलंबन से छोटे (1nm और 100 nm के बीच) होते हैं। इनके विलेय कणों को खुली आँखों से नहीं देखा जा सकता है तथा ये स्थायी होते हैं। कोलाइड टिंडल प्रभाव उत्पन्न करते हैं; जैसे रक्त, दूध, फेस क्रीम, मक्खन इत्यादि।
(d) निलंबन (Suspension): नितंबन एक विषमागी मिश्रण है, जिसमें विलेय पदार्थ के कण घुलते नहीं है, बल्कि माध्यम की समष्टि में निलंबित रहते हैं। ये निलंबित कण आँखों से देखे जा सकते हैं। यदि मिश्रण को कुछ देर तक बिना हिलाए छोड़ दें तो ठोस कण नीचे बैठे जाता है, जैसे कीचड़ का पानी, रेत का पानी चॉक पाउडर तथा पानी, पानी में चूना पत्थर इत्यादि।
5. निम्नलिखित में से प्रत्येक को समांगी और विषमांगी मिश्रणों में वर्गीकृत करें: सोडा जल, लकड़ी, बर्फ, वायु, मिट्टी, सिरका, छनी हुई चाय।
Ans. समांगी मिश्रण: सोडा जत, बर्फ, वायु सिरका, छनी हुई चाय।
विषमांगी मिश्रण: लकड़ी, मिट्टी।
6. आप किस प्रकार पुष्टि करेंगे कि दिया हुआ रंगहीन द्रव शुद्ध जल है?
Ans. यदि वायुमंडलीय दबाव पर दिया हुआ रंगहीन द्रव 100 C पर उबलता है तो हम कह सकते हैं कि दिया गया रंगहीन द्रव शुद्ध जल है, क्योंकि शुद्ध पदार्थों के क्वथनांक तथा गलनांक निश्चित (Fixed) होते हैं।
7. निम्नलिखित में से कौन-सी वस्तुएँ शुद्ध पदार्थ हैं?
(a) बर्फ
(b) दूध
(c) लोहा
(d) हाइड्रोक्लोरिक अम्ल
(e) कैल्सियम ऑक्साइड
(f) पारा
(g) इंट
(h) लकड़ी
(i) वायु
Ans. निम्नलिखित वस्तुएँ शुद्ध पदार्थ हैं:
(a) बर्फ
(c) लोहा
(d) हाइड्रोक्लोरिक अम्ल
(e) कैल्सियम ऑक्साइड
(f) पारा
8. निम्नलिखित मिश्रणों में से विलयन की पहचान करें।
(a) मिट्टी
(b) समुद्री जल
(c) वायु
(d) कोयला
(e) सोडा जल
Ans. दिए गए मिश्रणों में से विलयन हैं:
(b) समुद्री जल
(e) सोडा जल।
9. निम्नलिखित में से कौन टिनडल प्रभाव को प्रदर्शित
(a) नमक का घोल
(b) दूध
(c) कॉपर सल्फेट का विलयन
(d) स्टार्च विलयन
Ans. b) दूध तथा
(d) स्टार्च विलयन, क्योंकि ये कोलाइड विलयन हैं।
10. निम्नलिखित को तत्व, यौगिक तथा मिश्रण में वगाकृत करेंः
(a) सोडियम
(b) मिट्टी
(c) चीनी का घोल
(d) चाँदी
(e) कैल्सियम कार्बोनेट
(f) टिन
(g) सिलिकन
(h) कोयला
(i) वायु
(j) साबुन
(k) मीथेन
(l) कार्बन डाइऑक्साइड
(m) रक्त
Ans. तत्वः सोडियम, चांदी, टिन, सिलिकॉन
यौगिकः कैल्सियम कार्बोनेट, मीथेन, साबुन, कार्बन डाइऑक्साइड
मिश्रणः चीनी का घोल, मिट्टी, वायु, कोयला, रक्त
11. निम्नलिखित में से कौन-कौन से परिवर्तन रासायनिक हैं?
(a) पौधों की वृद्धि
(b) लोहे में जंग लगना
(c) लोहे के चूर्ण तथा बालू को मिलाना
(d) खाना पकाना
(e) भोजन का पाचन
(f) जल से बर्फ बनना
(g) मोमबत्ती का जलना
Ans. रासायनिक परिवर्तन हैं।
(a) पौधों में वृद्धि
(b) लोहे में जग लगना
(c) खाना पकाना
(d) भोजन का पाचन
(e) मोमबत्ती का जलना।
पृष्ठ संख्या 16
1. पदार्थ से आप क्या समझते हैं?
Ans. पदार्थ वे होते हैं जो एक ही प्रकार के कणों से मिलकर बने होते हैं तथा उस पदार्थ में मौजूद सभी कण समान रासायनिक प्रकृति के होते हैं, जैसे-सोना, ताँबा आदि।
2. समांगी और विषमांगी मिश्रणों में अंतर बताएँ।
Ans.
| समांगी मिश्रण | विषमांगी मिश्रण |
| इस मिश्रण में अलग-अलग घटकों को समान रूप से मिश्रित किया जाता है। | इस मिश्रण में अलग-अलग घटकों को समान रूप से मिश्रित नहीं किया जाता है। |
| इसको भौतिकी रूप से भागों में नहीं बाँटा जा सकता है। | इसको भौतिकी रूप से भागों में बाँटा जा सकता है। |
| घटकों को आसानी से नहीं देखा जा सकता। | घटकों को आसानी से देखा जा सकता हैं। |
| घटकों को आसानी से अलग नहीं किया जा सकता हैं। | घटकों को आसानी से अलग किया जा सकता हैं |
| उदाहरण- चीनी विलयन, सिरका | उदाहरण- चीनी और नमक का मिश्रण, दूध, स्याहीं, पेन्ट |
पृष्ठ संख्या 20
1. उदाहरण के साथ समांगी तथा विषमांगी मिश्रणों में विभेद कीजिए।
Ans.
| समांगी मिश्रण | विषमांगी मिश्रण |
| इस मिश्रण में अलग-अलग घटकों को समान रूप से मिश्रित किया जाता है। | इस मिश्रण में अलग-अलग घटकों को समान रूप से मिश्रित नहीं किया जाता है। |
| इसको भौतिकी रूप से भागों में नहीं बाँटा जा सकता है। | इसको भौतिकी रूप से भागों में बाँटा जा सकता है। |
| घटकों को आसानी से नहीं देखा जा सकता। | घटकों को आसानी से देखा जा सकता हैं। |
| घटकों को आसानी से अलग नहीं किया जा सकता हैं। | घटकों को आसानी से अलग किया जा सकता हैं |
| उदाहरण- चीनी विलयन, सिरका | उदाहरण- चीनी और नमक का मिश्रण, दूध, स्याहीं, पेन्ट |
2. विलयन, निलंबन और कोलाइड एक-दूसरे से किस प्रकार भिन्न हैं?
Ans.
| विलयन | निलंबन | कोलाइडल विलयन |
| विलयन एक समांगी मिश्रण है। | निलंबन एक असमांगी मिश्रण है। | कोलाइडल विलयन एक असमांगी मिश्रण है। |
| विलयन के कण का व्यास 1 nm (10-9 m) से कम होता है। | निलंबन के कण का व्यास 1 nm (10-9 m) से अधिक होता है। | कोलाइडल विलयन के कण का व्यास 1 nm (10-9 m) से अधिक होता है। |
| विलयन के कण प्रकाश की किरण को फैलाते नहीं हैं। इसलिए विलयन में प्रकाश का मार्ग नहीं दिखाई देता है। | निलंबन के कण प्रकाश की किरण को फैला देते हैं। इसलिए निलंबन में प्रकाश का मार्ग दिखाई देता है। | कोलाइडल विलयन के कण इतने छोटे होते हैं कि प्रकाश की किरण को आसानी से फैला देते हैं। |
| विलयन स्थाई होता है यानि विलयन को शांत छोड़ देने पर भी विलेय के कण नीचे नहीं बैठते हैं। | निलंबन अस्थाई होता है यानि निलंबन को शांत छोड़ देने पर उसके कण नीचे बैठ जाते हैं। | कोलाइडल विलयन स्थाई होता है यानि कोलाइडल विलयन को शांत छोड़ देने पर उसके कण नीचे नहीं बैठते हैं। |
| विलयन के कणों को छान कर अलग नहीं किया जा सकता है। | निलंबन के कणों को छान कर अलग किया जा सकता है। | कोलाइडल विलयन के कणों को अपकेंद्रीकरण तकनीक द्वारा अलग किया जा सकता है। |
3. एक संतृप्त विलयन बनाने के लिए 36 g सोडियम क्लोराइड को 100 g जल में 293 K पर घोला जाता है। इस तापमान पर इसकी सांद्रता प्राप्त करें।
Ans. विलेय पदार्थ का द्रव्यमान = 36 g
विलायक (जल) का द्रव्यमान = 100 g
विलयन का द्रव्यमान = विलेय का द्रव्यमान + विलायक का द्रव्यमान
= 36g + 100g
= 136 g
विलयन की सांद्रता = विलेय का द्रव्यमान /विलयन का द्रव्यमान x 100
=36 /136 ×100%
=26.4%

1 thought on “क्या हमारे आस-पास के पदार्थ शुद्ध हैं : अध्याय 2”