अध्याय 3 में हम पढ़ चुके हैं कि पदार्थ, परमाणुओं और अणुओं से मिलकर बने हैं। विभिन्न प्रकार के पदार्थों का अस्तित्व उन परमाणुओं के कारण होता है, जिनसे वे बने हैं। अब प्रश्न उठता है कि : (1) किसी एक तत्व का परमाणु दूसरे तत्व के परमाणुओं से भिन्न क्यों होता है? और (ii) क्या परमाणु वास्तव में अविभाज्य होते हैं, जैसा कि डाल्टन ने प्रतिपादित किया था या परमाणुओं के भीतर छोटे अन्य घटक भी विद्यमान होते हैं? इस अध्याय में हमें इस प्रश्न का उत्तर मिलेगा। हम अवपरमाणुक कणों और परमाणु के विभिन्न प्रकार के मॉडलों के बारे में पढ़ेंगे, जिनसे यह पता चलता है कि ये कण परमाणु के भीतर किस प्रकार व्यवस्थित होते हैं।
19वीं शताब्दी के अंत में वैज्ञानिकों के समक्ष सबसे बड़ी चुनौती थी, परमाणु की संरचना और उसके गुणों के बारे में पता लगाना। परमाणुओं की संरचना को अनेक प्रयोगों के आधार पर समझाया गया है।
परमाणुओं के अविभाज्य न होने के संकेतों में से एक संकेत स्थिर-विद्युत तथा विभिन्न पदार्थों द्वारा विद्युत चालन की परिस्थितियों के अध्ययन से मिला।
4.1 पदार्थों में आवेशित कण
पदार्थों में आवेशित कणों की प्रकृति को जानने के लिए, आइए हम निम्न क्रियाकलाप करें।
क्रियाकलाप 4.1
A. सूखे बालों पर कंघी कीजिए। क्या कंघी कागज के छोटे-छोटे टुकड़ों को आकर्षित करती है?
B. काँच की एक छड़ को सिल्क के कपड़े पर रगड़िए और इस छड़ को हवा से भरे गुब्बारे के पास लाइए। क्या होता है, ध्यान से देखिए।
इन क्रियाकलापों से क्या हम यह निष्कर्ष निकाल सकते हैं कि दो वस्तुओं को आपस में रगड़ने से उनमें विद्युत आवेश आ जाता है? यह आवेश कहाँ से आता है? इसका उत्तर तब मिला जब यह पता चला कि परमाणु विभाज्य है और आवेशित कणों से बना है।
परमाणु में उपस्थित आवेशित कणों का पता लगाने में कई वैज्ञानिकों ने योगदान दिया।
19वीं शताब्दी तक यह जान लिया गया था कि परमाणु साधारण और अविभाज्य कण नहीं है, बल्कि इसमें कम से कम एक अवपरमाणुक कण इलेक्ट्रॉन विद्यमान होता है, जिसका पता जे. जे. टॉमसन ने लगाया था। इलेक्ट्रॉन के संबंध में जानकारी प्राप्त होने के पहले, ई. गोल्डस्टीन ने 1886 में एक नए विकिरण की खोज की, जिसे उन्होंने ‘केनाल रे’ का नाम दिया। ये किरणें धनावेशित विकिरण थीं, जिसके द्वारा अंततः दूसरे अवपरमाणुक कणों की खोज हुई। इन कणों का आवेश इलेक्ट्रॉन के आवेश के बराबर, किंतु विपरीत था। इनका द्रव्यमान इलेक्ट्रॉनों की अपेक्षा लगभग 2000 गुणा अधिक होता है। उनको प्रोटॉन नाम दिया गया। सामान्यतः इलेक्ट्रॉन को e के द्वारा और प्रोटॉन को p के द्वारा दर्शाया जाता है। प्रोटॉन का द्रव्यमान 1 इकाई और इसका आवेश +1 लिया जाता है। इलेक्ट्रॉन का द्रव्यमान नगण्य और आवेश -1 माना जाता है।
ऐसा माना गया कि परमाणु प्रोटॉन और इलेक्ट्रॉन से बने हैं, जो परस्पर आवेशों को संतुलित करते हैं। यह भी प्रतीत हुआ कि प्रोटॉन परमाणु के सबसे भीतरी भाग में होते हैं। इलेक्ट्रॉनों को आसानी से निकाला जा सकता है लेकिन प्रोटॉनों को नहीं। अब सबसे बड़ा प्रश्न यह था कि ये कण परमाणु की संरचना किस प्रकार करते हैं? हमें इस प्रश्न का उत्तर नीचे मिलेगा।
4.2 परमाणु की संरचना
हमने अध्याय 3 में डाल्टन के परमाणु सिद्धांत के बारे में पढ़ा है, जिसके अनुसार परमाणु अविभाज्य और अविनाशी था। लेकिन परमाणु के भीतर दो मूल कणों, इलेक्ट्रॉन और प्रोटॉन की खोज ने डाल्टन के परमाणु सिद्धांत की इस धारणा को गलत साबित कर दिया। अब यह जानना आवश्यक था कि इलेक्ट्रॉन और प्रोटॉन परमाणु के भीतर किस तरह व्यवस्थित हैं। इसको समझाने के लिए बहुत से वैज्ञानिकों ने भिन्न-भिन्न प्रकार के मॉडलों को प्रस्तुत किया। जे. जे. टॉमसन पहले वैज्ञानिक थे जिन्होंने परमाणुओं की संरचना से संबंधित पहला मॉडल प्रस्तुत किया।
4.2.1 टॉमसन का परमाणु मॉडल
टॉमसन ने परमाणुओं की संरचना से संबंधित एक मॉडल प्रस्तुत किया, जो क्रिसमस केक की तरह था। इनके अनुसार परमाणु एक धनावेशित गोला था, जिसमें इलेक्ट्रॉन क्रिसमस केक में लगे सूखे मेवों की तरह थे। तरबूज का उदाहरण भी ले सकते हैं, जिसके अनुसार परमाणु में धन आवेश तरबूज के खाने वाले लाल भाग की तरह बिखरा है, जबकि इलेक्ट्रॉन धनावेशित गोले में तरबूज के बीज की भांति धँसे हैं (चित्र 4.1)।
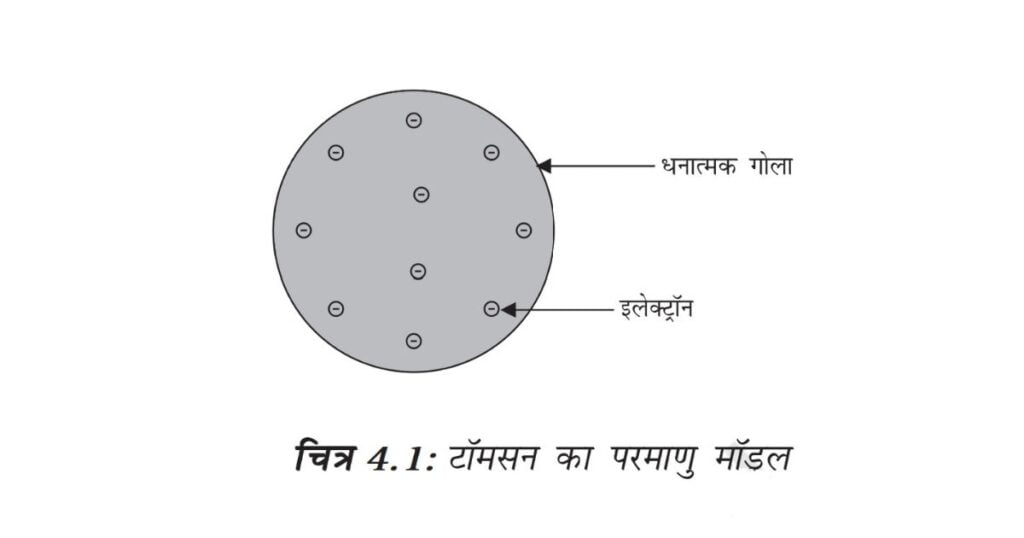
टॉमसन ने प्रस्तावित किया किः
(i) परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॉन उसमें धँसे होते हैं।
(ii) ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं।
यद्यपि टॉमसन के मॉडल से परमाणु के उदासीन होने की व्याख्या हो गई किंतु दूसरे वैज्ञानिकों द्वारा किए गए प्रयोगों के परिणामों को इस मॉडल के द्वारा समझाया नहीं जा सका, जैसा कि हम आगे देखेंगे।
4.2.2 रदरफोर्ड का परमाणु मॉडल
अरनेस्ट रदरफोर्ड यह जानने के इच्छुक थे कि इलेक्ट्रॉन परमाणु के भीतर कैसे व्यवस्थित हैं। उन्होंने एक प्रयोग किया। इस प्रयोग में, तेज़ गति से चल रहे अल्फ़ा कणों को सोने की पन्नी पर टकराया गया।
• इन्होंने सोने की पन्नी इसलिए चुनी क्योंकि वे बहुत पतली परत चाहते थे। सोने की यह पन्नी 1000 परमाणुओं के बराबर मोटी थी।
• अल्फ़ा कण द्विआवेशित हिलीयम कण होते हैं अतः ये धनावेशित होते हैं। चूँकि इनका द्रव्यमान 4u होता है इसलिए तीव्र गति से चल रहे इन अल्फ़ा कणों में पर्याप्त ऊर्जा होती है।
• यह अनुमान था कि अल्फ़ा कण सोने के परमाणुओं में विद्यमान अवपरमाणुक कणों के द्वारा विक्षेपित होंगे। चूँकि अल्फ़ा कण प्रोटॉन से बहुत अधिक भारी थे, इसलिए उन्होंने इनके अधिक विक्षेपण की आशा नहीं की थी।
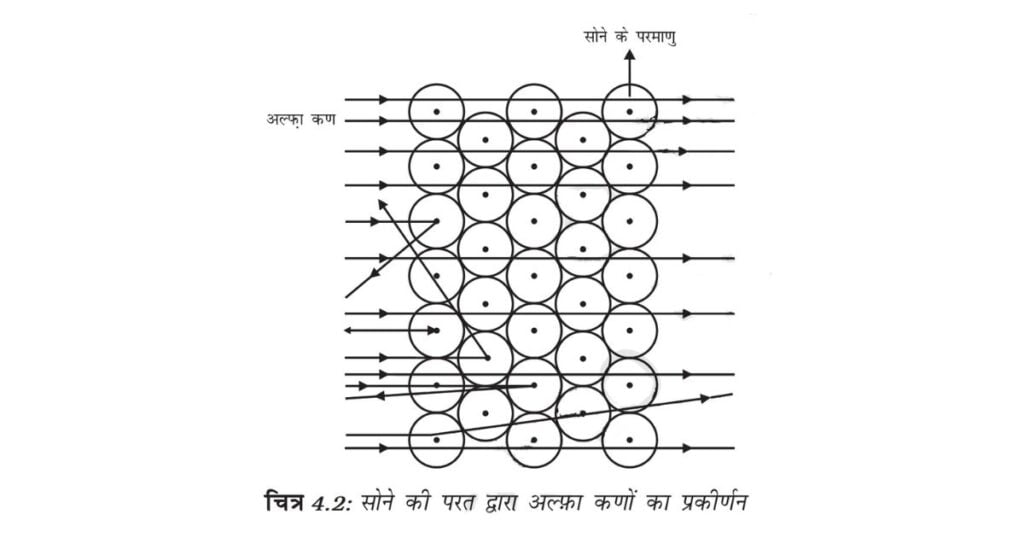
लेकिन अल्फा कण-प्रकीर्णन प्रयोग ने आशा के बिल्कुल विपरीत परिणाम दिया (चित्र 4.2)। इससे निम्नलिखित परिणाम मिले
(i) तेज गति से चल रहे अधिकतर अल्फ़ा कण सोने की पन्नी से सीधे निकल गए।
(ii) कुछ अल्फ़ा कण पन्नी के द्वारा बहुत छोटे कोण से विक्षेपित हुए।
(iii) आश्चर्यजनक रूप से प्रत्येक 12000 कणों में से एक कण वापस आ गया।
रदरफ्रेंड के अनुसार, “यह परिणाम उसी प्रकार अविश्वसनीय था, जैसे अगर आप एक 15 इंच के तोप के गोले को टिशू पेपर के टुकड़े पर मारते हैं और वह लौटकर आपको ही चोट पहुँचाता है।”
इस प्रयोग के निष्कर्ष को समझने के लिए खुले मैदान में एक क्रियाकलाप करते हैं। मान लें कि एक बच्चा अपनी आँखों को बंद किए हुए एक दीवार के सामने खड़ा है। उसे दीवार पर कुछ दूरी से पत्थर फेंकने को कहें। प्रत्येक पत्थर के दीवार से टकराने के साथ ही वह एक आवाज सुनेगा। अगर वह इसे दस बार दोहराएगा तो वह दस बार आवाज़ सुनेगा। लेकिन जब आँख बंद किया हुआ बच्चा तार से घिरी हुई चारदिवारी पर पत्थर फेंकेगा तो अधिकतर पत्थर उस घेरे पर नहीं टकराएँगे और कोई आवाज़ सुनाई नहीं पड़ेगी। क्योंकि घेरे के बीच में बहुत सारे खाली स्थान हैं, जिनके बीच से पत्थर निकल जाता है।
इसी तर्क के अनुसार, अल्फ़ा कण-प्रकीर्णन प्रयोग के आधार पर रदरफोर्ड ने निम्न परिणाम निकाले-
(i) परमाणु के भीतर का अधिकतर भाग खाली है क्योंकि अधिकतर अल्फ़ा कण बिना विक्षेपित हुए सोने की पन्नी से बाहर निकल जाते हैं।
(ii) बहुत कम कण अपने मार्ग से विक्षेपित होते हैं जिससे यह ज्ञात होता है कि परमाणु में धनावेशित भाग बहुत कम है।
(iii) बहुत कम अल्फ़ा कण 180° पर विक्षेपित हुए थे, जिससे यह संकेत मिलता है कि सोने के परमाणु का पूर्ण धनावेशित भाग और द्रव्यमान, परमाणु के भीतर बहुत कम आयतन में सीमित है। प्राप्त आँकड़ों के आधार पर उन्होंने यह निष्कर्ष निकाला कि नाभिक की त्रिज्या परमाणु की त्रिज्या से 100000 गुणा छोटी है।
अपने प्रयोगों के आधार पर रदरफ़ोर्ड ने परमाणु का नाभिकीय-मॉडल प्रस्तुत किया, जिसके निम्नलिखित लक्षण थेः
(i) परमाणु का केंद्र धनावेशित होता है जिसे नाभिक कहा जाता है। एक परमाणु का लगभग संपूर्ण द्रव्यमान नाभिक में होता है।
(ii) इलेक्ट्रॉन नाभिक के चारों ओर वर्तुलाकार मार्ग में चक्कर लगाते हैं।
(iii) नाभिक का आकार परमाणु के आकार की तुलना में काफी कम होता है।
रदरफोर्ड के परमाणु मॉडल की कमियाँ
वर्तुलाकार मार्ग में चक्रण करते हुए इलेक्ट्रॉन का स्थायी हो पाना संभावित नहीं है। कोई भी आवेशित कण गोलाकार कक्ष में त्वरित होगा। त्वरण के दौरान आवेशित कणों से ऊर्जा का विकिरण होगा। इस प्रकार स्थायी कक्ष में घूमता हुआ इलेक्ट्रॉन अपनी ऊर्जा विकिरित करेगा और नाभिक से टकरा जाएगा। अगर ऐसा होता, तो परमाणु अस्थिर होता जबकि हम जानते हैं कि परमाणु स्थायी होते हैं।
4.2.3 बोर का परमाण्विक मॉडल
रदरफोर्ड के मॉडल पर उठी आपत्तियों को दूर करने के लिए, नील्स बोर ने परमाणु की संरचना के बारे में निम्नलिखित अवधारणाएँ प्रस्तुत कीं-
(i) इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉन की विविक्त कक्षा कहते हैं।
(ii) जब इलेक्ट्रॉन इस विविक्त कक्षा में चक्कर लगाते हैं, तो उनकी ऊर्जा का विकिरण नहीं होता है।
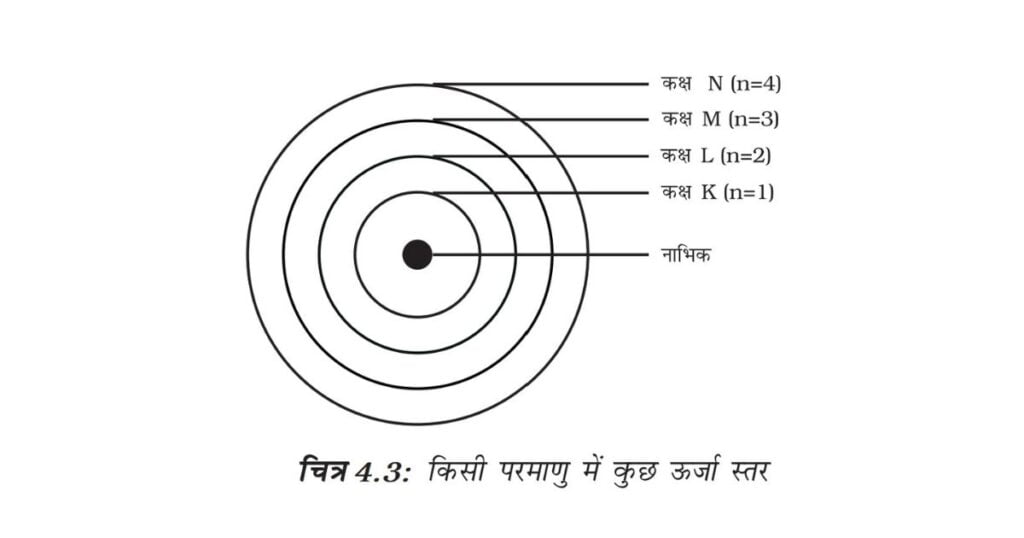
इन कक्षाओं (या कोशों) को ऊर्जा स्तर कहते हैं। चित्र 4.3 में एक परमाणु के ऊर्जा स्तरों को दिखाया गया है।
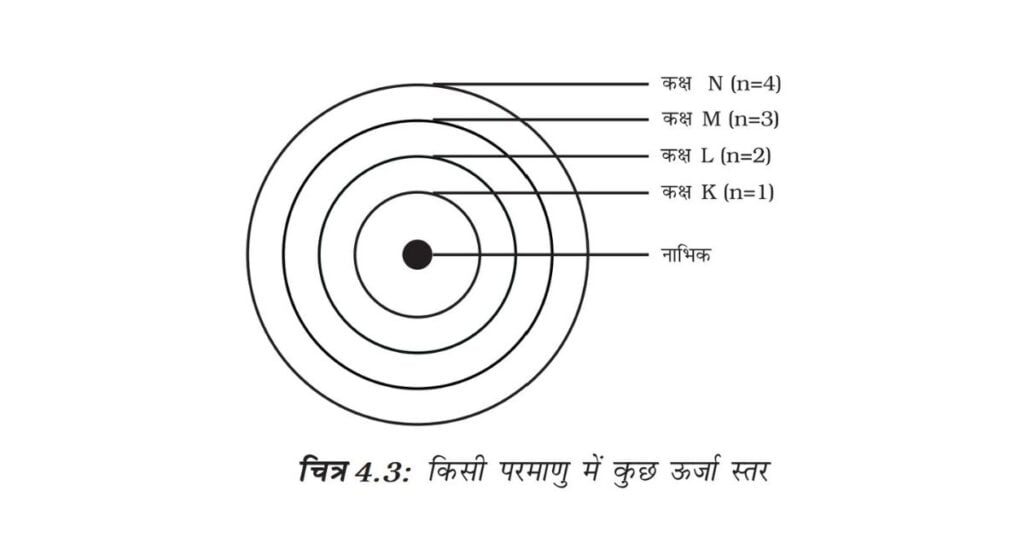
ये कक्षाएँ (या कोश) K,L,M,N……. या संख्याओं, 1, 2, 3, 4…….. के द्वारा दिखाई जाती हैं।
4.2.4 न्यूट्रॉन
1932 में जे. चैडविक ने एक और अवपरमाणुक कण को खोज निकाला, जो अनावेशित और द्रव्यमान में प्रोटॉन के बराबर था। अंततः इसका नाम न्यूट्रॉन पड़ा। हाइड्रोजन को छोड़कर ये सभी परमाणुओं के नाभिक में होते हैं। समान्यतः, न्यूट्रॉन को ‘n’ से दर्शाया जाता है। परमाणु का द्रव्यमान नाभिक में उपस्थित प्रोटॉन और न्यूट्रॉन के द्रव्यमान के योग के द्वारा प्रकट किया जाता है।
4.3 विभिन्न कक्षाओं में इलेक्ट्रॉन कैसे वितरित होते हैं?
परमाणुओं की विभिन्न कक्षाओं में इलेक्ट्रॉनों के वितरण के लिए बोर और बरी ने कुछ नियम प्रस्तुत किए जिसे बोर बरी स्कीम के नाम से जाना जाता है।
(i) इन नियमों के अनुसार किसी कक्षा में उपस्थित अधिकतम इलेक्ट्रॉनों की संख्या को सूत्र 2n² से दर्शाया जाता है, जहाँ ‘n’ कक्षा की संख्या या ऊर्जा स्तर है। इसलिए इलेक्ट्रॉनों की अधिकतम संख्या पहले कक्ष या K कोश में होगी = 2 × 1² = 2, दूसरे कक्ष या L कोश में होगी = 2 × 2² = 8, तीसरे कक्ष या M कोश में होगी = 2 × 3²= 18, चौथे कक्ष या N कोश में होगी = 2 x 4² = 32
(ii) सबसे बाहरी कोश में इलेक्ट्रॉनों की अधिकतम संख्या 8 हो सकती है।
(iii) किसी परमाणु के दिए गए कोश में इलेक्ट्रॉन तब तक स्थान नहीं लेते हैं जब तक कि उससे पहले वाले भीतरी कक्ष पूर्ण रूप से भर नहीं जाते। इससे स्पष्ट होता है कि कक्षाएँ क्रमानुसार भरती हैं।
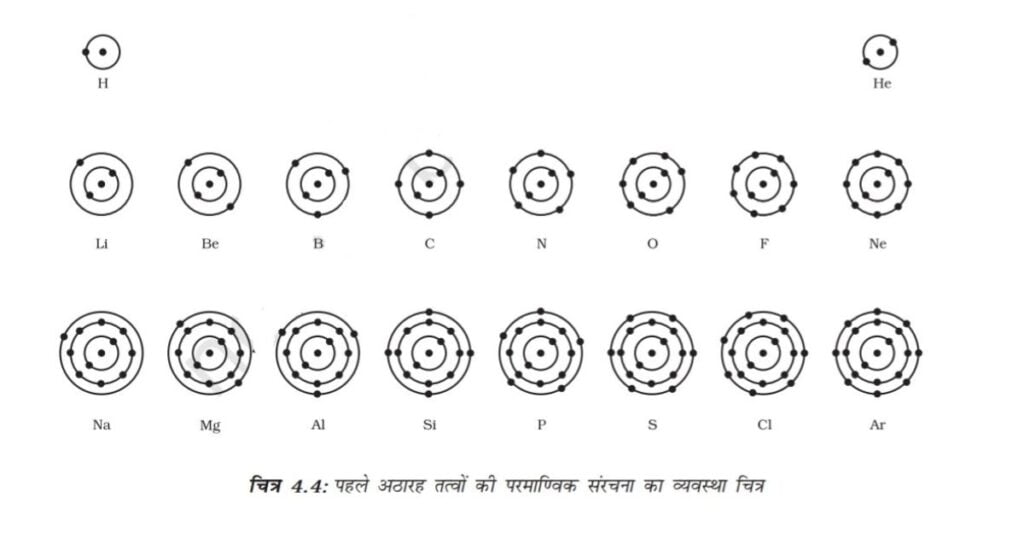
पहले 18 तत्वों की परमाणु संरचना के व्यवस्था चित्र को चित्र 4.4 में दिखाया गया है।
क्रियाकलाप 4.2
स्थायी परमाण्विक मॉडल तैयार करें तथा पहले अठारह तत्वों के इलेक्ट्रॉनिक विन्यास को दिखाएँ। पहले अठारह तत्वों के परमाणुओं की संयोजन सारणी 4.1 में दी गई है।
4.4 संयोजकता
हम पढ़ चुके हैं कि परमाणुओं की विभिन्न कक्षाओं (या कोशों) में इलेक्ट्रॉन किस प्रकार व्यवस्थित होते हैं। किसी परमाणु की सबसे बाहरी कक्षा में उपस्थित इलेक्ट्रानों को संयोजकता-इलेक्ट्रॉन कहा जाता है।
बोर-बरी स्कीम से हम जानते हैं कि किसी परमाणु का बाह्यतम कक्ष अधिकतम 8 इलेक्ट्रॉन रख सकता है। यह देखा गया था कि जिन तत्वों के परमाणुओं के बाह्यतम कक्ष पूर्ण रूप से इलेक्ट्रॉनों (8) से भरे होते हैं वे रासायनिक रूप से सक्रिय नहीं होते हैं। दूसरे शब्दों में, ऐसे तत्वों की संयोजन-शक्ति या संयोजकता शून्य होती है। इन अक्रिय तत्वों में से हीलियम-परमाणु के बाह्यतम कक्ष में दो (2) इलेक्ट्रॉन होते हैं और अन्य में आठ (8) होते है। सक्रिय तत्वों के परमाणुओं की संयोजन-शक्ति अर्थात् अपने समान या अन्य किसी तत्व के परमाणुओं से मिलकर अणु बनाने की प्रवृत्ति, अपने बाह्यतम कक्ष को पूर्ण रूप से भरने का प्रयास माना जाता है। आठ इलेक्ट्रॉन वाले सबसे बाहरी (बाह्यतम) कक्ष को अष्टक माना जाता है। परमाणु अपने अंतिम कक्ष में अष्टक प्राप्त करने के लिए क्रिया करते हैं। यह आपस में इलेक्ट्रॉनों की साझेदारी करने, उनको ग्रहण करने या उनका त्याग करने से होता है। परमाणु के बाह्यतम कक्ष में इलेक्ट्रॉनों के अष्टक बनाने के लिए जितनी संख्या में इलेक्ट्रॉनों की साझेदारी या स्थानांतरण होता है, वही उस तत्व की संयोजकता-शक्ति अर्थात् संयोजकता होती है, जिसकी चर्चा पिछले अध्याय में की गई है। उदाहरण के लिए, हाइड्रोजन, लीथियम या सोडियम प्रत्येक के परमाणुओं के बाह्यतम कक्ष में एक-एक इलेक्ट्रॉन होता है। अतः यह एक इलेक्ट्रॉन का त्याग कर सकते हैं। इसलिए उनकी संयोजकता एक (1) कही जाती है। क्या आप बता सकते हैं कि मैग्नीशियम और एल्युमिनियम की संयोजकता क्या है? यह क्रमशः 2 और 3 है क्योंकि मैग्नीशियम के बाह्यतम कक्ष में 2 तथा एलुमिनियम के 3 इलेक्ट्रॉन होते हैं।
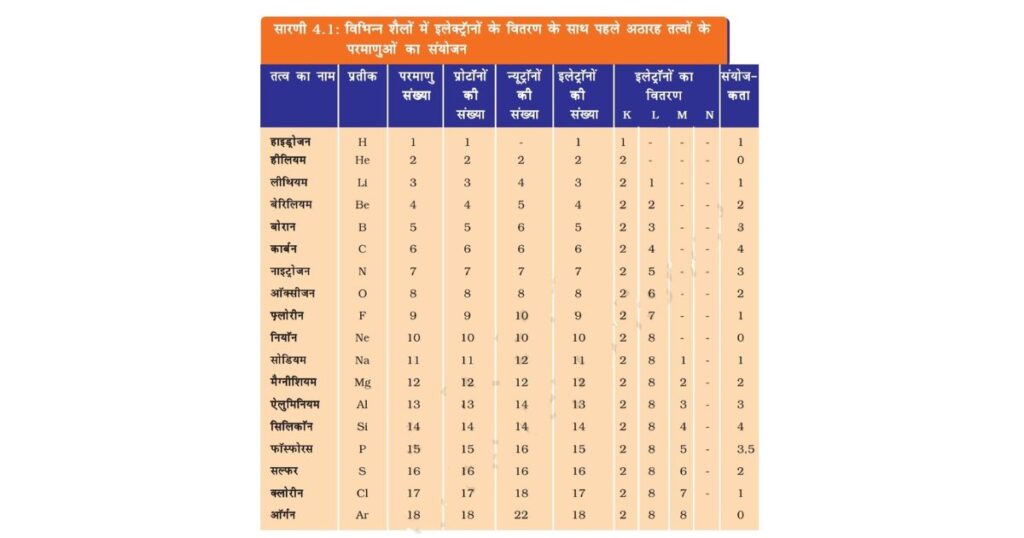
यदि किसी परमाणु के बाह्यतम कक्ष में इलेक्ट्रॉनों की संख्या उसकी क्षमता के अनुसार लगभग पूरी है तो संयोजकता एक अन्य प्रकार से प्राप्त की जाती है। उदाहरण के लिए, फ़्लोरीन परमाणु के बाह्यतम कक्ष में सात (7) इलेक्ट्रॉन होते हैं और इसकी संयोजकता सात (7) हो सकती है किंतु बाह्यतम कक्ष में अष्टक बनाने के लिए फ्लोरीन के लिए 7 इलेक्ट्रॉनों का त्याग करने की अपेक्षा एक (1) इलेक्ट्रॉन प्राप्त करना अधिक आसान है। अतः इसकी संयोजकता अष्टक (8) में से सात (7) घटाकर प्राप्त की जाती है और इस तरह फ़्लोरीन की संयोजकता एक (1) है। ऑक्सीजन की संयोजकता का परिकलन भी इसी प्रकार किया जा सकता है। इस परिकलन से ऑक्सीजन की संयोजकता कितनी होगी?
अतः प्रत्येक तत्व के परमाणु की एक निश्चित संयोजन-शक्ति होती है, जिसे संयोजकता कहते हैं।
पहले 18 तत्वों की संयोजकता सारणी 4.1 के अंतिम स्तंभ में दी गई है।
4.5 परमाणु संख्या तथा द्रव्यमान संख्या
4.5.1 परमाणु संख्या
हम जानते हैं कि परमाणु के नाभिक में प्रोटॉन विद्यमान होते हैं। एक परमाणु में उपस्थित प्रोटॉनों की संख्या उसकी परमाणु संख्या को बताती है। इसे 2 के द्वारा दर्शाया जाता है। किसी तत्व के सभी अणुओं की परमाणु संख्या (2) समान होती है। वास्तव में तत्वों को उनके परमाणु में विद्यमान प्रोटॉनों की संख्या से परिभाषित किया जाता है। हाइड्रोजन के लिए Z = 1, क्योंकि हाइड्रोजन परमाणु के नाभिक में केवल एक प्रोटॉन होता है। इसी प्रकार, कार्बन के लिए Z = 6. इस प्रकार, एक परमाणु के नाभिक में उपस्थित प्रोटॉनों की कुल संख्या को परमाणु संख्या कहते हैं।
4.5.2 द्रव्यमान संख्या
एक परमाणु के अवपरमाणुक कणों के अध्ययन के बाद हम इस निष्कर्ष पर पहुँच सकते हैं कि व्यावहारिक रूप में परमाणु का द्रव्यमान उसमें विद्यमान प्रोटॉनों और न्यूट्रॉनों के द्रव्यमान के कारण होता है। ये परमाणु के नाभिक में विद्यमान होते हैं इसलिए इन्हें न्यूक्लियॉन भी कहते हैं। परमाणु का लगभग संपूर्ण द्रव्यमान उसके नाभिक में होता है। उदाहरण के लिए, कार्बन का द्रव्यमान 12u है क्योंकि इसमें 6 प्रोट्रॉन और 6 न्यूट्रॉन होते हैं, 6 u + 6 u = 12 । इसी प्रकार, ऐलुमिनियम का द्रव्यमान 27 u है (13 प्रोटॉन + 14 न्यूट्रॉन)। एक परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों की कुल संख्या के योग को द्रव्यमान संख्या कहा जाता है।
किसी परमाणु को दर्शाने के लिए परमाणुक संख्या, द्रव्यमान-संख्या और तत्व का प्रतीक इस प्रकार से लिखा जाता है।
4.6 समस्थानिक
प्रकृति में, कुछ तत्वों के परमाणुओं की पहचान की गई है, जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या अलग-अलग होती है। उदाहरण के लिए, हाइड्रोजन परमाणु को लें। इसके तीन परमाण्विक स्पीशीज़ होते हैं: प्रोटियम 1H1, ड्यूटीरियम (2H1 या D), ट्राइटियम ( 3H1 या T), प्रत्येक की परमाणु संख्या समान है। लेकिन द्रव्यमान संख्या क्रमशः 1, 2 और 3 है। इस तरह के अन्य उदाहरण हैं: (1) कार्बन, 12C6 और 14C6; (2) क्लोरीन, 35C17 और 37C17
इन उदाहरणों के आधार पर समस्थानिकों को इस प्रकार परिभाषित किया जा सकता है, “एक ही तत्व के परमाणु जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न होती है।” इस तरह हम कह सकते हैं कि हाइड्रोजन परमाणु के तीन समस्थानिक प्रोटियम, ड्यूटीरियम और ट्राइटियम होते हैं।
बहुत से तत्वों में समस्थानिक का मिश्रण भी होता है। किसी तत्व का प्रत्येक समस्थानिक शुद्ध पदार्थ होता है। समस्थानिकों के रासायनिक गुण समान लेकिन भौतिक गुण अलग-अलग होते हैं।
प्रकृति में क्लोरीन दो समस्थानिक रूपों में पाया जाता है, जिसका द्रव्यमान 35u और 37u, जो 3: 1 के अनुपात में होते हैं। अब यह प्रश्न उठता है कि किस द्रव्यमान को क्लोरीन परमाणु का द्रव्यमान मानना चाहिए? आइए इसका पता लगाएँ।
क्लोरीन का औसत परमाणु द्रव्यमान होगा,
35 x 75/100 + 37 x 25 / 100
=105 /4 + 37 / 4 = 142 / 4 = 35.5 u
किसी प्राकृतिक तत्व के एक परमाणु का द्रव्यमान उस तत्व में विद्यमान सभी प्राकृतिक रूप से पाए जाने वाले परमाणुओं के औसत द्रव्यमान के बराबर होता है। अगर किसी एक तत्व का कोई समस्थानिक नहीं है तो परमाणु का द्रव्यमान उसमें उपस्थित प्रोटॉन और न्यूट्रॉनों के द्रव्यमान का योग होता है लेकिन अगर एक तत्व समस्थानिक रूप में उपस्थित होता है तो हमें प्रत्येक समस्थानिक रूप का प्रतिशत जानना होगा और औसत द्रव्यमान की गणना करनी होगी।
इसका मतलब यह नहीं है कि क्लोरीन के परमाणु का द्रव्यमान एक भिन्नात्मक संख्या 35.5u है। इसका तात्पर्य यह हुआ कि अगर आप क्लोरीन की कुछ मात्रा लेते हैं तो इसमें क्लोरीन के समस्थनिक होंगे और औसत द्रव्यमान 35.5 u होगा।
समस्थानिकों के अनुप्रयोग
कुछ समस्थानिकों के विशेष गुण होते हैं, जिनका उपयोग हम विभिन्न क्षेत्रों में करते हैं। उनमें से कुछ निम्नलिखित हैं:
(1) यूरेनियम के एक समस्थानिक का उपयोग परमाणु भट्टी में ईंधन के रूप में होता है।
(11) कैंसर के उपचार में कोबाल्ट के समस्थानिक का उपयोग होता है।
(iii) घेघा रोग के इलाज में आयोडीन के समस्थानिक का उपयोग होता है।
4.6.1 समभारिक
दो तत्वों- कैल्शियम, परमाणु संख्या 20 और आर्गन परमाणु संख्या 18 के बारे में विचार कीजिए। परमाणुओं में प्रोटॉनों की संख्या भिन्न-भिन्न है, दोनों तत्वों की द्रव्यमान संख्या 40 है। यानी, तत्वों के इस जोड़े के अणुओं में कुल न्यूक्लियॉनों की संख्या समान है। अलग-अलग परमाणु संख्या वाले तत्वों को जिनकी द्रव्यमान संख्या समान होती है, समभारिक कहा जाता है।
आपने क्या सीखा
• इलेक्ट्रॉन और प्रोटॉन की खोज क्रमशः जे. जे. टॉमसन और ई. गोल्डस्टीन ने की।
• जे. जे. टॉमसन ने यह प्रस्तावित किया था कि इलेक्ट्रॉन धनात्मक गोले में भैंसे होते हैं।
• रदरफोर्ड के अल्फा कणों के प्रकीर्णन प्रयोग ने परमाणु केंद्रक की खोज की।
• रदरफोर्ड के परमाणु मॉडल ने प्रस्तावित किया कि परमाणु के अंदर बहुत छोटा केंद्रक होता है और इलेक्ट्रॉन केंद्रक के चारों ओर घूमते हैं। परमाणु की स्थिरता की इस मॉडल से व्याख्या नहीं की जा सकी है।
• नील बोर द्वारा दिया गया परमाणु का मॉडल अधिक सफल था। उन्होंने प्रस्तावित किया कि इलेक्ट्रॉन केंद्रक के चारों ओर निश्चित ऊर्जा के साथ अलग-अलग कक्षाओं में वितरित हैं। अगर परमाणु की सबसे बाहरी कक्षाएँ भर जाती हैं, तो परमाणु स्थिर होगा और कम क्रियाशील होगा।
• जे. चैडविक ने परमाणु के अंदर न्यूट्रॉन की उपस्थिति को खोजा। इस प्रकार परमाणु के तीन अवपरमाणुक कण हैं- इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन। इलेक्ट्रॉन ऋण आवेशित होते हैं, प्रोटॉन धनावेशित होते हैं और न्यूट्रॉन अनावेशित होते हैं। इलेक्ट्रॉन का द्रव्यमान हाइड्रोजन परमाणु के द्रव्यमान के 1/2000 गुणा होता है। प्रोटॉन और न्यूट्रॉन में प्रत्येक का द्रव्यमान एक इकाई लिया जाता है।
• परमाणु के कक्षों को K, L, M, N…… नाम दिया गया है। संयोजकता परमाणु की संयोजन शक्ति है।
• एक तत्व की परमाणु संख्या केंद्रक में विद्यमान प्रोटॉनों की संख्या के बराबर होती है।
• परमाणु की द्रव्यमान संख्या केंद्रक में विद्यमान न्यूक्लियानों की संख्या के बराबर होती हैं।
• समस्थानिक एक ही तत्व के परमाणु हैं जिनकी द्रव्यमान संख्या भिन्न-भिन्न होती है।
• समभारिक वे परमाणु हैं जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न-भिन्न होती है।
• तत्वों को उनके प्रोटॉनों की संख्या के आधार पर परिभाषित किया जा सकता है।
यह भी पढ़ें : परमाणु एवं अणु : अध्याय 3
अभ्यास
1. इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना कीजिए।
Ans.
| गुण | इलेक्ट्रॉन | प्रोटॉन | न्यूट्रॉन |
| संकेत | e – | p+ | n |
| आवेश | -1 | +1 | 0 |
| द्रव्यमान | 9.109 × 10-31 kg | 1.673 × 10-27 kg | 1.675 × 10-27 kg |
| एब्सोल्यूट आवेश | आवेश (ऋणात्मक) 1.6 × 10-19कूलम्ब | आवेश (धनात्मक) 1.6 × 1019 कूलम्ब | 0 |
2. जे. जे. टॉमसन के परमाणु मॉडल की क्या सीमाएँ हैं?
Ans. जे.जे. टॉमसन के मॉडल से परमाणु के उदासीन होने की व्याख्या हुई, परंतु दूसरे वैज्ञानिकों द्वारा किए गए प्रयोगों के परिणामों को इस मॉडल के द्वारा समझाया नहीं जा सका।
जैसे – रदरफ़ोर्ड के α – कण प्रकीर्णन प्रयोग में ज्यादातर अल्फा-कण सीधे क्यों निकल गए, कुछ अल्फा-कण बहुत छोटे कोण से क्यों विक्षेपित हुए और बहुत कम कण वापस क्यों आ गए? इन प्रश्नों की व्याख्या करने में यह मॉडल असफल रहा।
अथवा
जे. जे. टॉमसन के परमाणु मॉडल की निम्नलिखित सीमाएँ हैं:
- जे. जे. टॉमसन के परमाणु मॉडल इलेक्ट्रॉन की अवस्था को सही तरीके से नहीं बता पाया था।
- यह मॉडल परमाणु के केन्द्र कभी पता लगाने में असमर्थ था।
- जे. जे. टॉमसन के परमाणु मॉडल में केवल परमाणु के उदासीन होने की ब्याख्या की गई किंतु दूसरे वैज्ञानिकों द्वारा किये गये प्रयोगों में इसे नहीं समझाया जा सका।
3. रदरफोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं?
Ans. यदि कोई भी आवेशित कण गोलाकार कक्ष में त्वरित होगा तो आवेशित कणों से ऊर्जा का विकिरण होगा, जिससे इसकी ऊर्जा निरंतर घटती जाएगी और इसकी गति भी कम होती जाएगी। अंततः स्थायी कक्ष में घूमता हुआ इलेक्ट्रॉन एक सर्पिल (Spiral) पथ का निर्माण कर नाभिक से टकरा जाएगा। अगर ऐसा होता, तो परमाणु अस्थिर होता जबकि हम जानते हैं। कि परमाणु स्थायी होते हैं। परमाणु समाप्त या नष्ट नहीं होते।
अतः रदरफ़ोर्ड का परमाणु मॉडल परमाणु के स्थायित्व की व्याख्या कर पाने में असफल रहा।
4. बोर के परमाणु मॉडल की व्याख्या कीजिए।
Ans. नील्स बोर ने परमाणु की संरचना के बारे में निम्नलिखित अवधारणाएँ प्रस्तुत कीं|
(i) परमाणु के केंद्र में एक धनावेशित नाभिक होता है। प्रोटॉन और न्यूट्रॉन नाभिक में होते हैं।
(ii) इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं, जिन्हें इलेक्ट्रॉन की विविक्त कक्षा (Discrete Orbits) कहते हैं।
(iii) जब इलेक्ट्रॉन इस विविक्त कक्षा में चक्कर लगाते हैं, तो उनकी ऊर्जा का विकिरण नहीं होता।
इन कक्षाओं (या कोशों) को ऊर्जा-स्तर कहते हैं, जिन्हें K, L, M, N…….. या संख्याओं 1, 2, 3, 4, ……. के द्वारा दिखाया जाता है।
5. इस अध्याय में दिए गए सभी परमाणु मॉडलों की तुलना कीजिए।
Ans.
जे.जे. टॉमसन का परमान मॉडल:
- परमाणु एक धन आवेशित गोला होता है और इलेक्ट्रॉन इसकी सतह पर धंसे होते हैं
- किसी भी परमाणु में इलेक्ट्रॉनों की संख्या और प्रोटोनों की संख्या के बराबर होती है। जिसके कारण ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु विद्युत के रूप से उदासीन होते हैं।
रदरफोर्ड का परमाणु मॉडल:
- परमाणु का केंद्र धन आवेशित होता है जिसे नाभिक कहा जाता है।
- परमाणु का लगभग संपूर्ण द्रव्यमान नाभिक में होता है।
- इलेक्ट्रॉन नाभिक के चारो और निश्चित कक्षाओं में वर्तुलाकार मार्ग से चक्कर लगाते हैं।
- नाभिक का आकार परमाणु के आकार की तुलना में काफी छोटा होता है।
नील्स बोर का परमाणु मॉडल:
- इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं। जिन्हें इलेक्ट्रॉन की विशेष कक्षा कहा जाता है।
- जब इलेक्ट्रॉन इन विवीक्त कक्षा में चक्कर लगाते हैं तो उसकी ऊर्जा का विकिरण नहीं होती है।
- ये कक्षाएं है K, L, M, N, ………
6. पहले अठारह तत्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के नियम को लिखिए।
Ans. परमाणुओं की विभिन्न कक्षाओं में इलेक्ट्रॉनों के वितरण के लिए बोर और बरी ने निम्नलिखित नियम प्रस्तुत किए।
(i) किसी कक्षा में उपस्थित अधिकतम इलेक्ट्रॉनों की संख्या 2n2 से दर्शाया जाता है; जहाँ ‘n’ कक्षा की संख्या या ऊर्जा स्तर है।
(ii) सबसे बाहरी कोश में इलेक्ट्रॉनों की अधिकतम संख्या 8 हो सकती है।
(iii) किसी परमाणु के दिए गए कोश में इलेक्ट्रॉन तब तक स्थान नहीं लेते हैं जब तक कि उससे पहले वाले भीतरी कक्ष पूर्णरूप से भर नहीं जाते। इससे स्पष्ट होता है कि कक्षाएँ क्रमानुसार भरती हैं।
7. सिलिकॉन और ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
Ans.
परमाणु के अष्टक बनाने के लिए जितने इलेक्ट्रॉन के स्थानांतरण या साझा करने की जरूरत होती है वही उस तत्व की संयोजकता कहलाती है। उदाहरण: Si(14) = 2, 8, 4
सिलिकॉन की बाहरी कक्षा में 4 इलेक्ट्रॉन हैं यानि यह 4 इलेक्ट्रॉन ले सकता है या दे सकता है या साझा कर सकता है। इसलिए सिलिकॉन की संयोजकता = 4। उदाहरण: O(8) = 2, 6
ऑक्सीजन की बाहरी कक्षा में 6 इलेक्ट्रॉन हैं यानि यह 2 इलेक्ट्रॉन ले सकता है या 6 इलेक्ट्रॉन दे सकता है। 6 इलेक्ट्रॉन दान करने की तुलना में 2 इलेक्ट्रॉन लेना अधिक आसान है। इसलिए ऑक्सीजन की संयोजकता = 2
8. उदाहरण के साथ व्याख्या कीजिए- परमाणु संख्या, द्रव्यमान संख्या, समस्थानिक और समभारिक समस्थानिकों के कोई दो उपयोग लिखिए।
Ans. परमाणु संख्या (Atomic Number) – एक तत्त्व की परमाणु संख्या नाभिक (केंद्रक) में विद्यमान प्रोटॉनों की कुल संख्या के बराबर होती है। इसे Z के द्वारा दर्शाया जाता है। हाइड्रोजन के लिए Z = 1 क्योंकि हाइड्रोजन परमाणु के नाभिक में केवल एक प्रोटॉन होता है। इसी प्रकार, सोडियम की परमाणु संख्या Z = 11 है।
द्रव्यमान संख्या (Mass Number) – एक परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों की कुल संख्या के योग को द्रव्यमान संख्या कहा जाता है। उदाहरण के लिए, कार्बन का द्रव्यमान संख्या 12u है। क्योंकि इसमें 6 प्रोटॉन और 6 न्यूट्रॉन होते हैं, 6u + 6u = 12u.
इसी प्रकार, फॉस्फोरस की द्रव्यमान संख्या = 31u है।
क्योंकि
प्रोटॉनों की संख्या = 15,
न्यूट्रॉनों की संख्या = 16
द्रव्यमान संख्या = 15 + 16 = 31
समस्थानिक (Isotopes) – एक ही तत्त्व के परमाणु जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न होती हैं, समस्थानिक कहलाते हैं।
जैसे-हाइड्रोजन के तीन समस्थानिक हैं- प्रोटियम (1H1), ड्यूटीरियम (2H1 या D), ट्राइटियम ( 3H1 या T), प्रत्येक की परमाणु संख्या 1 है परंतु द्रव्यमान संख्या क्रमशः 1, 2, 3 है। इसी प्रकार कार्बन के दो समस्थानिक हैं- (12H6) और (14H6)
समभारिक (Isobars) – समभारिक विभिन्न तत्त्वों के वे परमाणु हैं, जिनकी द्रव्यमान संख्या समान लेकिन परमाणु संख्या भिन्न-भिन्न होती है। उदाहरण के लिए, कैल्सियम Ca और आर्गन की परमाणु संख्या क्रमशः 20 और 18 है परंतु दोनों तत्त्वों की द्रव्यमान संख्या 40 है। इसलिए,(40C20) और (40Ar18) समभारिक हैं।
समस्थानिकों के दो उपयोग निम्नलिखित हैं|
(i) कैंसर के उपचार में कोबाल्ट के समस्थानिक का उपयोग होता है।
(ii) यूरेनियम के एक समस्थानिक का उपयोग परमाणु भट्टी (Atomic Reactor) में ईंधन के रूप में होता है।
9. Na के पूरी तरह से भरे हुए K व L कोश होते हैं- व्याख्या कीजिए।
Ans.
सोडियम Na की परमाणु संख्या = 11 इलेक्ट्रॉनिक विन्यासः
K L M
2 8 1
चूँकि सोडियम के बाह्यतम कक्ष (कोश) में 1 इलेक्ट्रॉन है इसलिए यह एक इलेक्ट्रॉन का त्याग करके (Na’) आयन बनाता है और अपना अष्टक पूर्ण करता है।
Na+ में 10 इलेक्ट्रॉन होते हैं यानी K कोश में 2 तथा L कोश में 8 हम जानते हैं कि K कोश में अधिकतम = 2 × 1² = 2 तथा L कोश में अधिकतम = 2 × 2² = 8 इलेक्ट्रॉन रह सकते हैं।
अत: Na+ में K और L कोश पूर्णतः भरे हुए हैं।
10. अगर ब्रोमीन परमाणु दो समस्थानिकों [(79Br35) (49.7%)] तथा [(81Br35) (50.3%)] के रूप में है, तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान की गणना कीजिए।
Ans.
दिया है (79Br35) का द्रव्यमान = 79u तथा अनुपातः 49.70% तथा (81Br35) का द्रव्यमान = 81u तथा अनुपात = 50.3%
अतः ब्रोमीन का औसत द्रव्यमान
=(79 × 49.7/100) + (81 × 50.3/100)
= 3926.3/100 + 4074.3/100
= 8000.6/100
= 80 u
11. एक तत्व X का परमाणु द्रव्यमान 16.2 u है तो इसके किसी एक नमूनें में समस्थानिक (16X8)और (18X8) का प्रतिशत क्या होगा?
Ans.
माना कि तत्व x के नमूने में समस्थानिक (16X8)का प्रतिशत = x
इसलिए, तत्व x के नमूने में समस्थानिक (18X8) का प्रतिशत = 100 – x
x का औसत परमाणु द्रव्यमान = 16 × X/100 + 18× (100-X)/100
16.2 = 16× X/100 + 18 × (100-X)/100
1620 = 16x + 18 (100-X)
1620 = 16x + 1800 – 18x
2x = 180
x = 90
अतः, (16X8) = 90%
(18X8)= 100- 90 = 10%
12. यदि तत्व का Z = 3 हो तो तत्व की संयोजकता क्या होगी? तत्व का नाम भी लिखिए।
Ans. परमाणु संख्या प्रतीक = Z,
अतः, परमाणु संख्या = 3
इलेक्ट्रॉनिक विन्यास = 2, 1
इसलिए, संयोजकता = 1
अतः, तत्व का नाम लिथियम Li है।
13. दो परमाणु स्पीशीज के केंद्रकों का संघटन नीचे दिया गया।
| X | Y | |
| प्रोटॉन | 6 | 6 |
| न्यूट्रॉन | 6 | 8 |
प्रोटॉन न्यूट्रॉन X और Y है? X और Y की द्रव्यमान संख्या ज्ञात कीजिए। इन दोनों स्पीशीज में क्या संबंध है ?
Ans. द्रव्यमान संख्या = (प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या)
अतः X का परमाणु द्रव्यमान = 6 + 6 = 12
X की परमाणु संख्या = प्रोटॉनों की संख्या = 6
Y को द्रव्यमान संख्या = 6 + 8 = 14
Y की परमाणु संख्या = प्रोटॉनों की संख्या = 6
चूँकि दो परमाणु स्पीशीज़ X और Y की परमाणु संख्या 6 समान है परंतु उनकी द्रव्यमान संख्या अलग-अलग 12 और 14 है।
अत: ये दोनों एक दूसरे के समस्थानिक हैं अर्थात कार्बन के समस्थानिक (12H6) और (14H6) हैं।
14. निम्नलिखित वक्तव्यों में गलत के लिए F और सही के लिए T लिखें।
(a) जे. जे. टॉमसन ने यह प्रस्तावित किया था कि परमाणु के केंद्रक में केवल न्यूक्लीयॉन्स होते हैं। (F)
(b) एक इलेक्ट्रॉन और प्रोटॉन मिलकर न्यूट्रॉन का निर्माण करते हैं इसलिए यह अनावेशित होता है। (F)
(c) इलेक्ट्रॉन का द्रव्यमान प्रोटॉन से लगभग 1/2000 गुणा होता है। (T)
(d) आयोडीन के समस्थानिक का इस्तेमाल टिंक्चर आयोडीन बनाने में होता है। इसका उपयोग दवा के रूप में होता है। (F)
प्रश्न संख्या 15, 16 और 17 में सही के सामने (√) का चिह्न और गलत के सामने (×) का चिह्न लगाइए।
15. रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था-
(a) परमाणु केंद्रक
(b) इलेक्ट्रॉन
(c) प्रोटॉन
(d) न्यूट्रॉन
Ans. (a) परमाणु केंद्रक
16. एक तत्व के समस्थानिक में होते हैं-
(a) समान भौतिक गुण
(b) भिन्न रासायनिक गुण
(c) न्यूट्रॉनों की अलग-अलग संख्या
(d) भिन्न परमाणु संख्या
Ans. (c) न्यूट्रॉनों की अलग-अलग संख्या
17. Cl– आयन में संयोजकता इलेक्ट्रॉनों की संख्या है-
(a) 16
(b) 8
(c) 17
(d) 18
Ans. (b) 8
18. सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में कौन सा है?
(a) 2,8
(b) 8,2,1
(c) 2,1,8
(d) 2,8,1
Ans. (d) 2,8,1
पृष्ठ संख्या 43
1. केनाल किरणें क्या हैं?
Ans. केनाल किरणें धनावेशित विकिरण हैं जो एनोड से कैथोड की ओर चलती हैं। इन्हें एनोड किरणें भी कहते हैं। केनाल किरणों के कारण ही धन आवेशित अवपरमाणुक कण प्रोटॉन की खोज हुई।
2. यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है, तो इसमें कोई आवेश होगा या नहीं?
Ans. हम जानते हैं कि प्रत्येक इलेक्ट्रॉन पर 1 इकाई ऋण आवेश और प्रत्येक प्रोटॉन पर 1 इकाई धन आवेश होता है। इसलिए आवेश की संख्या समान परंतु विपरीत होने के कारण परमाणु पर कोई आवेश नहीं होता और वे उदासीन होते हैं।
पृष्ठ संख्या 46
1. परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए।
Ans. टॉमसन मॉडल के अनुसारः
(i) परमाणु धन आवेशित गोले का बना होता है। और इलेक्ट्रॉन उसमें फँसे होते हैं।
(ii) ऋणात्मक और धनात्मक आवेश परिमाण में समान होते हैं। इसलिए परमाणु वैद्युतीय रूप से उदासीन होते हैं।
2. रदरफ़ोर्ड के परमाणु मॉडल के अनुसार, परमाणु के नाभिक में कौन-सा अवपरमाणुक कण विद्यमान है?
Ans. रदरफ़ोर्ड के परमाणु मॉडल के अनुसार परमाणु का केंद्र धनावेशित होता है, जिसे नाभिक कहा जाता है। इसलिए नाभिक में अवपरमाणुक कण प्रोटॉन विद्यमान होते हैं क्योंकि प्रोटॉन धनावेशित होता है।
3. तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र बनाइए।
Ans.
4. क्या अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से संभव होगा?
उत्तर: हाँ, 7-कणों का प्रकीर्णन किसी भी धातु की पन्नी से संभव है और परिणाम वही प्राप्त होगा क्योंकि सभी धातुओं के परमाणुओं की संरचना एक जैसी होती है।
पृष्ठ संख्या 46
1. परमाणु के तीन अवपरमाणुक कणों के नाम लिखें।
उत्तर: परमाणु के तीन अवपरमाणुक कणों के नाम हैं
(i) इलेक्ट्रॉन
(ii) प्रोटॉन
(iii) न्यूट्रॉन
2. हीलियम परमाणु का परमाणु द्रव्यमान 4u है और उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रॉन होंगे?
उत्तर: हीलियम (He) का परमाणु द्रव्यमान = 4u
परमाणु द्रव्यमान = न्यूट्रॉन की संख्या + प्रोटॉन की संख्या
⇒ 4 = न्यूट्रॉन की संख्या + 2
⇒ न्यूट्रॉन की संख्या = 4 – 2
⇒ न्यूट्रॉन की संख्या = 2
अत: हीलियम परमाणु में न्यूट्रॉनों की संख्या = 2 है।
पृष्ठ संख्या 47
1. कार्बन और सोडियम के परमाणुओं के लिए इलेक्ट्रॉन-वितरण लिखिए।
उत्तर: कार्बन के परमाणु में इलेक्ट्रॉनों की संख्या = 6
इलेक्ट्रॉन-वितरण
| कक्ष | इलेक्ट्रॉन की संख्या |
| K | 2 |
| L | 4 |
सोडियम के परमाणु में इलेक्ट्रॉनों की संख्या = 11
इलेक्ट्रॉन-वितरण
| कक्ष | इलेक्ट्रॉन की संख्या |
| K | 2 |
| L | 8 |
| M | 1 |
2. अगर किसी परमाणु का K और L कोश भरा है तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी?
उत्तर: K कोश में अधिकतम 2 तथा L कोश में अधिकतम 8 इलेक्ट्रॉन रह सकते हैं। चूंकि ये दोनों कोश भरे हैं।
इसलिए इस परमाणु में इलेक्ट्रानों की कुल संख्या = 2 + 8 = 10 होगी।
पृष्ठ संख्या 48
1. क्लोरीन, सल्फर और मैग्नीशियम की परमाणु संख्या से आप इसकी संयोजकता कैसे प्राप्त करेंगे?
उत्तर: हम जानते हैं कि परमाणु के बाह्यतम कक्ष में अष्टक बनाने के लिए जितनी संख्या में इलेक्ट्रॉनों की साझेदारी या स्थानांतरण होता है, वही उस तत्त्व की संयोजकता-शक्ति अर्थात् संयोजकता होती है।
(i) क्लोरीन, परमाणु संख्या = 17
प्रोटॉन = 17, इलेक्ट्रॉन = 17
इलेक्ट्रॉनों का वितरणः
K L M
2 8 7
चूँकि Cl के बाह्यतम कोश में 7 इलेक्ट्रॉन हैं। इसलिए अष्टक पूर्ण करने के लिए 1 इलेक्ट्रॉन ग्रहण करेगा ताकि निकटतम अक्रिय गैस इलेक्ट्रॉनिक विन्यास प्राप्त कर सके।
Cl की संयोजकता = 8 – 7 = 1 है।
(ii) सल्फर परमाणु संख्या = 16
इलेक्ट्रॉन 16, प्रोटॉन = 16
इलेक्ट्रॉनों का वितरणः
K L M
2 8 6
सल्फर को अष्टक पूर्ण करने के लिए 2 इलेक्ट्रॉनों की आवश्यकता है। सल्फर 2 इलेक्ट्रॉन ग्रहण कर अष्टक पूर्ण करेगा।
इसलिए सल्फर की संयोजकता = 8 – 6 = 2
(iii) मैग्नीशियम, परमाणु संख्या = 12
इलेक्ट्रॉनों की संख्या = 12 प्रोटॉनों की संख्या = 12
इलेक्ट्रॉनों का वितरणः
K L M
2 8 2
चूँकि बाह्यतम कोश में इलेक्ट्रॉनों की संख्या 2 है, इसलिए मैग्नीशियम 2 इलेक्ट्रॉनों का परित्याग कर अष्टक पूर्ण करेंगे।
मैग्नीशियम की संयोजकता = 2 है।
पृष्ठ संख्या 49
1. यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब,
(a) परमाणु की परमाणुक संख्या क्या है?
(b) परमाणुक का क्या आवेश है?
उत्तर:
(a) प्रोटॉनों की संख्या = 8
परमाणु संख्या = प्रोटॉनों की संख्या = 8
(b) प्रोटॉनों की संख्या = 8
इलेक्ट्रॉनों की संख्या = 8
चूँकि प्रत्येक प्रोटॉन का आवेश (+1) और प्रत्येक इलेक्ट्रॉन का आवेश (-1) होता है।
कुल आवेश =(+ 8)+(-8) = 0
अतः परमाणु पर कोई आवेश नहीं है। यह उदासीन है।
2. सारणी 4.1 की सहायता से ऑक्सीजन और सल्फर-परमाणु की द्रव्यमान संख्या ज्ञात कीजिए।
उत्तर: एक परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों की संख्या के योग को द्रव्यमान संख्या कहा जाता है।
अर्थात द्रव्यमान संख्या = प्रोटॉन की संख्या + न्यूट्रॉन की संख्या
ऑक्सीजनः प्रोटॉन = 8, न्यूट्रॉन = 8 द्रव्यमान संख्या = 8 + 8 = 16 u
सल्फरः प्रोटॉन = 16, न्यूट्रॉन = 16
द्रव्यमान संख्या = 16 + 16 = 32 u
पृष्ठ संख्या 50
1. चिन H, D और T के लिए प्रत्येक में पाए जाने वाले तीन अवपरमाणुक कणों को सारणीबद्ध कीजिए।
Ans.
प्रोटियम (1H1) में
प्रोटॉन= 1, इलेक्ट्रान=1 और न्यूट्रॉन=0
ड्यूटीरियम (2H1 या D) में
प्रोटॉन= 1, इलेक्ट्रान=1 और न्यूट्रॉन=1
ट्राइटियम (3H1 या T)
प्रोटॉन= 1, इलेक्ट्रान=1 और न्यूट्रॉन=2
2. समस्थानिक और समभारिक के किसी एक युग्म का इलेक्ट्रॉनिक विन्यास लिखिए।
Ans. समस्थानिक: किसी एक ही तत्व के परमाणु जिनकी परमाणु संख्या तो समान है। लेकिन द्रव्यमान संख्या भिन्न-भिन्न होती है, उन्हें समस्थानिक कहलाते हैं। जैसे: कार्बन, 12C6, 14C6
| K | L | |
| 12C6 | 2 | 4 |
| 14C6 | 2 | 4 |
समभारिक: अलग-अलग तत्वों के परमाणु जिनकी द्रव्यमान संख्या तो समान होती है। लेकिन परमाणु संख्या भिन्न-भिन्न होती है, समभारिक कहलातें हैं। जैसे: 40Ca20, 40Ar16
| K | L | M | N | |
| 40Ca20 | 2 | 8 | 8 | 2 |
| 40Ar16 | 2 | 8 | 6 |

1 thought on “परमाणु की संरचना : अध्याय 4”