आपने पिछली कक्षाओं में अध्ययन किया होगा। कि भोजन का खट्टा एवं कड़वा स्वाद आ भोजन में विद्यमान क्रमशः अम्ल एवं क्षारक के कारण होता है। यदि आपके परिवार का कोई सदस्य अत्यधिक भोजन करने के कारण अम्लता से पीड़ित है तो आप कौन सा उपचार सुझाएँगे? नींबू पानी, सिरका या बेकिंग सोडा का विलयन?
• उपचार बताते समय आप किस गुणधर्म का ध्यान रखेंगे? आप जानते हैं कि अम्ल एवं क्षारक एक-दूसरे के प्रभाव को समाप्त करते हैं। आपने अवश्य ही इसी जानकारी का उपयोग किया होगा।
• याद कीजिए कि कैसे हमने बिना स्वाद चखे ही खटें एवं कड़वे पदार्थों की जाँच की थी। आप जानते हैं कि अम्लों का स्वाद खट्टा होता है तथा यह नीले लिटमस पत्र को लाल कर देते हैं। जबकि क्षारकों का स्वाद कड़वा होता है एवं यह लाल लिटमस पत्र को नीला कर देते हैं। लिटमस एक प्राकृतिक सूचक होता है। इसी प्रकार हल्दी (turmeric) भी एक ऐसा ही सूचक है। क्या आपने कभी ध्यान दिया है कि श्वेत कपड़े पर लगे सब्जी के दाग पर जब क्षारकीय प्रकृति वाला साबुन रगड़ते हैं तब उस धब्बे का रंग भूरा-लाल हो जाता है? लेकिन कपड़े को अत्यधिक जल से धोने के पश्चात् वह फिर से पीले रंग का हो जाता है। अम्ल एवं क्षारक की जाँच के लिए आप संश्लेषित (synthetic) सूचक जैसे मेथिल ऑरेंज (methyl orange) एवं फीनॉल्फथेलिन (phenolphthalein) का भी उपयोग कर सकते हैं।
इस अध्याय में हम अम्ल एवं क्षारक की अभिक्रियाओं के बारे में अध्ययन करेंगे। हमें जानकारी प्राप्त होगी कि अम्ल एवं क्षारक कैसे एक-दूसरे के प्रभाव को समाप्त कर देते हैं। साथ ही दैनिका जीवन में पाई जाने वाली तथा उपयोग में आने वाली बहुत सी रोचक वस्तुओं के बारे में भी हम अध्ययन करेंगे।
2.1 अम्ल एवं क्षारक के रासायनिक गुणधर्म समझना
2.1.1 प्रयोगशाला में अम्ल एवं क्षारक
क्रियाकलाप 2.1
• विज्ञान की प्रयोगशाला से हाइड्रोक्लोरिक अम्ल (HCI), सल्फ्यूरिक अम्ल (H2SO4), नाइट्रिक अम्ल (HNO3), ऐसीटिक अम्ल (CH3COOH), सोडियम हाइड्रॉक्साइड (NaOH), कैल्सियम हाइड्रॉक्साइड ([Ca(OH), ])] पोटेशियम हाइड्रॉक्साइड (KOH) मैग्नीशियम हाइड्रॉक्साइड ([Mg(OH)2]) एवं अमोनियम हाइड्रॉक्साइड (NH4 OH) के विलयनों के नमूने एकत्र कीजिए।
• ऊपर दिए गए प्रत्येक विलयन की एक बूँद वाच ग्लास में बारी-बारी से रखिए एवं सारणी 2.1 के अनुसार निम्नलिखित सूचकों से उसकी जाँच कीजिए।
• लाल लिटमस, नीले लिटमस, फेनॉलप्थेलियन एवं मेथिल ऑरेंज विलयन के साथ लिए गए विलयन के रंग में क्या-क्या परिवर्तन होते हैं?
• अपने प्रेक्षण को सारणी 2.1 में लिखिए।
सारणी 2.1
| विलयन का नमूना | लाल लिटमस विलयन | नीला लिटमस विलयन | फीनॉल्फथेलिन विलयन | मेथिल ऑरेंज विलयन |
रंग में परिवर्तन के द्वारा यह सूचक हमें बताते हैं कि कोई पदार्थ अम्ल है या क्षारका कुछ ऐसे पदार्थ होते हैं, जिनकी गंध अम्लीय या क्षारकीय माध्यम में भिन्न हो जाती है। इन्हें गंधीय (Olfactory) सूचक कहते हैं। आइए, इनमें से कुछ सूचकों की जाँच करें।
क्रियाकलाप 2.1
• बारीक कटी हुई प्याज तथा स्वच्छ कपड़े के टुकड़े को एक प्लास्टिक के थैले में लीजिए। थैले को कस कर बाँध दीजिए तथा पूरी रात फ्रिज में रहने दीजिए। अब इस कपड़े के टुकड़े का उपयोग अम्ल एवं क्षारक की जाँच के लिए किया जा सकता है।
• इसमें से दो टुकड़े लीजिए एवं उनकी गंध की जाँच कीजिए।
• इन्हें स्वच्छ सतह पर रखकर उनमें से एक टुकड़े पर तनु HCI विलयन की कुछ बूँदें एवं दूसरे पर तनु NaOH विलयन की कुछ बूँदें डालिए।
• दोनों टुकड़ों को जल से धोकर उनकी गंध की पुनः जाँच कीजिए।
• अपने प्रेक्षणों को लिखिए।
• अब थोड़ा तनु वैनिला एवं लौंग का तेल लीजिए तथा इनकी गंधों की जाँच कीजिए।
• एक परखनली में तनु HCI विलयन एवं दूसरी में तनु NaOH का विलयन लीजिए। दोनों में तनु वैनिला एसेंस की कुछ बूँदें डालकर उसे हिलाइए। उसकी गंध की पुनः जाँच कीजिए। यदि गंध में कोई बदलाव है तो उसे दर्ज कीजिए।
• इसी प्रकार तनु HCI एवं तनु NaOH के साथ लौंग के तेल (clove oil) की गंध में आए परिवर्तन की जाँच कर अपने प्रेक्षण को दर्ज कीजिए।
आपके प्रेक्षण के आधार पर वैनिला, प्याज एवं लौंग के तेल में से किसे गंधीय (olfactory) सूचक की तरह उपयोग किया जा सकता है?
अम्ल एवं क्षारक के रासायनिक गुणधर्मों को समझने के लिए आइए, कुछ और क्रियाकलाप करते हैं।
2.1.2 अम्ल एवं क्षारक धातु के साथ कैसे अभिक्रिया करते हैं?
क्रियाकलाप 2.3
• चित्र 2.1 के अनुसार उपकरण व्यवस्थित कीजिए।
• एक परखनली में लगभग 5 mL तनु सल्फ्यूरिक अम्ल लीजिए। एवं इसमें दानेदार जिंक के टुकड़े डालिए।
• दानेदार जिंक के टुकड़ों की सतह पर आप क्या देखते हैं?
• उत्सर्जित गैस को साबुन के विलयन से प्रवाहित कीजिए।
• साबुन के विलयन में बुलबुले क्यों बनते हैं?
• जलती हुई मोमबत्ती को गैस वाले बुलबुले ले के पास ले जाइए।
• आप क्या प्रेक्षण करते हैं?
• कुछ अन्य अम्ल जैसे HCI, HNO3 एवं CH3COOH के साथ यह क्रियाकलाप दोहराइए। प्रत्येक स्थिति में आपका प्रेक्षण समान है या भिन्न?
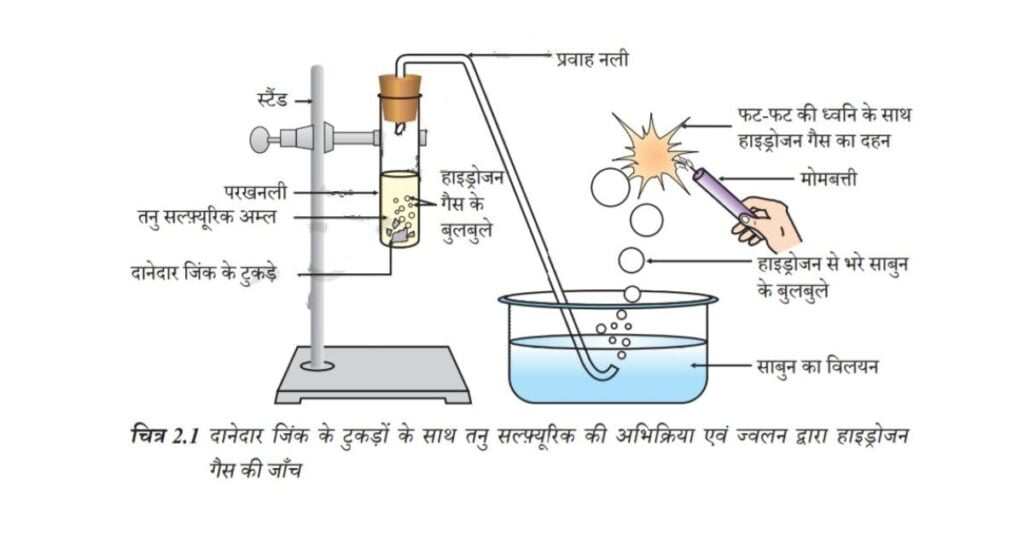
चित्र 2.1 दानेदार जिंक के टुकड़ों के साथ तनु सल्फ्यूरिक की अभिक्रिया एवं ज्वलन द्वारा हाइड्रोजन गैस की जाँच
ध्यान दीजिए कि ऊपर दी गई अभिक्रियाओं में घातु, अम्लों से हाइड्रोजन परमाणुओं का हाइड्रोजन गैस के रूप में विस्थापन करती है और एक यौगिक बनाता है, जिसे लवण कहते हैं। अम्ल के साथ धातु की अभिक्रिया को इस प्रकार व्यक्त कर सकते हैं-
अम्ल + धातु → लवण + हाइड्रोजन गैस
आपने जिन अभिक्रियाओं का प्रेक्षण किया है, क्या आप उनका समीकरण लिख सकते हैं?
क्रियाकलाप 2.4
• एक परखनली में जिंक के कुछ दानेदार टुकड़े रखिए।
• उसमें 2 mL सोडियम हाइड्रॉक्साइड का घोल मिलाकर उसे गर्म कीजिए।
• तत्पश्चात, क्रियाकलाप 2.3 के अनुसार क्रियाओं को दोहराइए एवं अपने प्रेक्षण को लिखिण
इस अभिक्रिया को निम्न प्रकार से लिख सकते हैं
2NaOH(aq)+Zn(s) → Na2 ZnO2(s) + H2(g) (सोडियम जिकेट)
आप देखेंगे कि अभिक्रिया में पुनः हाइड्रोजन बनता है, , किंतु ऐसी अभिक्रियाएँ सभी धातुओं के साथ संभव नहीं हैं।
2.1.3 धातु कार्बोनेट तथा धातु हाइड्रोजनकार्बोनेट अम्ल के साथ कैसे अभिक्रिया करते हैं?
क्रियाकलाप 2.5
• दो परखनलियाँ लीजिए। उन्हें ‘A’ एवं ‘B’ से नामांकित कीजिए।
• परखनली ‘A’ में लगभग 0.5 g सोडियम कार्बोनेट (Na2CO3) लीजिए एवं परखनली ‘B’ में 0.5 g सोडियम हाइड्रोजनकार्बोनेट (Na2HCO3) लीजिए।
• दोनों परखनलियों में लगभग 2 mL तनु HCI मिलाइए।
• आपने क्या निरीक्षण किया?
• चित्र 2.2 के अनुसार प्रत्येक स्थिति में उत्पादित गैस को चूने के पानी (कैल्सियम हाइड्रॉक्साइड का विलयन) से प्रवाहित कीजिए एवं अपने निरीक्षणों को अभिलिखित कीजिए।
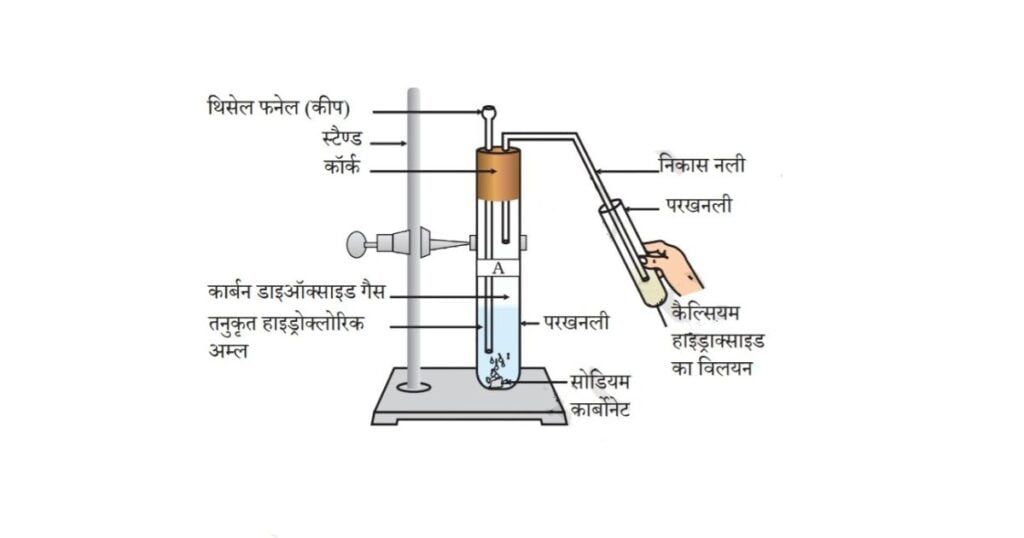
चित्र 2.2 कैल्सियम हाइड्रॉक्साइड में से कार्बन डाइऑक्साइड गैस को गुज़ारना
उपरोक्त क्रियाकलाप में होने वाली अभिक्रियाओं को इस प्रकार लिखा जाता है:
परखनली ‘A’: Na2CO3 (s) + 2HCl(aq) → 2NaCl(aq) + H2O(1) + CO2(g)
परखनली ‘B’ : NaHCO3 (s) + HCl(aq) → NaCl(aq) + H2O(1) + CO2(g)
उत्पादित कार्बन डाइऑक्साइड गैस को चूने के पानी से प्रवाहित करने पर,
Ca(OH)2 (aq) (चूने का पानी) + CO2 (g) → CaCO3(s) (श्वेत अवक्षेप) + H2O(1)
अत्यधिक मात्रा में कार्बन डाइऑक्साइड प्रवाहित करने पर निम्न अभिक्रिया होती है-
CaCO3(s) + H2O(1) + CO2 (g) → Ca(HCO3 )2 (aq)
(जल में विलयशील) चूना-पत्थर (limestone), खड़िया (chalk) एवं संगमरमर (marble) कैल्सियम कार्बनिट के विविध रूप हैं। सभी धातु कार्बोनेट एवं हाइड्रोजनकार्बोनेट अम्ल के साथ अभिक्रिया करके संगत लवण, कार्बन डाइऑक्साइड एवं जल बनाते हैं।
इस अभिक्रिया को इस प्रकार से व्यक्त कर सकते हैं-
धातु कार्बोनट/धातु हाइड्रोजनकार्बोनेट + अम्ल → लवण कार्बन डाइऑक्साइड + जल
2.1.4 अम्ल एवं क्षारक परस्पर कैसे अभिक्रिया करते हैं?
क्रियाकलाप 2.6
• परखनली में लगभग 2 mL NaOH का घोल लीजिए एवं उसमें दो बूँदै फीनॉल्फथैलिन विलयन डालिए।
• विलयन का रंग क्या है?
• इस विलयन में एक-एक बूँद तनु। HCI विलयन मिलाइए।
• क्या अभिक्रिया मिश्रण के रंग में कोई परिवर्तन आया?
• अम्ल मिलाने के बाद फीनॉल्फथैलिन का रंग क्यों बदल गया?
• अब उपरोक्त मिश्रण में NaOH की कुछ बूँदें मिलाइए।
• क्या फीनॉल्फथैलिन पुनः गुलाबी रंग का हो गया?
• आपके विचार से ऐसा क्यों होता है?
उपरोक्त क्रियाकलाप में हमने प्रेक्षण किया कि अम्ल द्वास क्षारक का प्रेक्षित प्रभाव तथा क्षारक द्वारा अम्ल का प्रभाव समाप्त हो जाता है। अभिक्रिया को इस प्रकार लिख सकते हैं
NaOH(aq) + HCl(aq) →NaCl(aq) + H2O(1)
अम्ल एवं क्षारक की अभिक्रिया के परिणामस्वरूप लवण तथा जल प्राप्त होते हैं तथा इसे उदासीनीकरण अभिक्रिया कहते हैं। सामान्यतः उदासीनीकरण अभिक्रिया को इस प्रकार लिख सकते हैं-
क्षारक + अम्ल → लवण + जल
2.1.5 अम्लों के साथ धात्विक ऑक्साइडों की अभिक्रियाएँ
क्रियाकलाप 2.7
• बीकर में कॉपर ऑक्साइड की अल्प मात्रा लीजिए एवं हिलाते हुए उसमें धीरे-धीरे तनु हाइड्रोक्लोरिक अम्ल मिलाइए।
• विलयन के रंग पर ध्यान दीजिए। कॉपर ऑक्साइड का क्या हुआ?
आप देखेंगे कि विलयन का रंग नील-हरित हो जाएगा एवं कॉपर ऑक्साइड घुल जाता है। विलयन का नील-हरित रंग अभिक्रिया में कॉपर (II) क्लोराइड के बनने के कारण होता है। धातु ऑक्साइड एवं अम्ल के बीच होने वाली सामान्य अभिक्रिया को इस प्रकार लिख सकते हैं:
धातु ऑक्साइड + अम्ल → लवण + जल
अब उपरोक्त अभिक्रिया के लिए समीकरण लिखकर उसे संतुलित कीजिए। क्षारक एवं अम्ल की अभिक्रिया के समान ही धात्विक ऑक्साइड अम्ल के साथ अभिक्रिया करके लवण एवं जल प्रदान करते हैं, अतः धात्विक ऑक्साइड को क्षारकीय ऑक्साइड भी कहते हैं।
2.1.6 क्षारक के साथ अधात्विक ऑक्साइड की अभिक्रियाएँ
क्रियाकलाप 2.5 में आपने कार्बन डाइऑक्साइड एवं कैल्सियम हाइड्रॉक्साइड (चूने का पानी) के बीच हुई अभिक्रिया देखी। कैल्सियम हाइड्रॉक्साइड जो एक क्षारक है, कार्बन डाइऑक्साइड के साथ अभिक्रिया करके लवण एवं जल का निर्माण करता है। चूँकि यह क्षारक एवं अम्ल के बीच होने वाली अभिक्रिया के समान है, अतः हम यह निष्कर्ष निकाल सकते हैं कि अधात्विक ऑक्साइड अम्लीय प्रकृति के होते हैं।
2.2 सभी अम्लों एवं क्षारकों में क्या समानताएँ हैं?
अनुभाग 2.1 में हमने देखा कि सभी अम्लों में समान रासायनिक गुणधर्म होते हैं। गुणधर्मों में समानता क्यों होती है? हमने क्रियाकलाप 2.3 में देखा कि धातु के साथ अभिक्रिया करने पर सभी अम्ल हाइड्रोजन गैस उत्पन्न करते हैं। इससे पता चलता है कि सभी अम्लों में हाइड्रोजन होता है। आइए, एक क्रियाकलाप के माध्यम से हम जाँच करें कि क्या हाइड्रोजन युक्त सभी यौगिक अम्लीय होते हैं।
क्रियाकलाप 2.8
• ग्लूकोज़, एल्कोहल, हाइड्रोक्लोरिक अम्ल, सल्फ्यूरिक अम्ल आदि का विलयन लीजिए।
• एक कॉर्क पर दो कीलें लगाकर कॉर्क को 100 mL. के बीकर में रख दीजिए।
• चित्र 2.3 के अनुसार कीलों को 6 वोल्ट की एक बैटरी के दोनों टर्मिनलों के साथ एक बल्ब तथा स्विच के माध्यम से जोड़ दीजिए।
• अब बीकर में थोड़ा तनु HCI डालकर विद्युत धारा प्रवाहित कीजिए।
• इसी क्रिया को तनु सल्फ्यूरिक अम्ल के साथ दोहराइए।
• आपने क्या प्रेक्षण किया?
• इन परीक्षणों को ग्लूकोज़ एवं एल्कोहल के विलयनों के साथ अलग-अलग दोहराइए। अब आपने क्या प्रेक्षण किया?
• बल्ब क्या प्रत्येक स्थिति में जलता है?
चित्र 2.3 जल में अम्ल का विलयन विद्युत चालन करता है
अम्ल की स्थिति में बल्ब जलने लगता है जैसा कि चित्र 2.3 में दिखाया गया है। परंतु आप यह देखेंगे कि ग्लूकोज़ एवं एल्कोहल का विलयन विद्युत का चालन नहीं करते हैं। बल्ब के जलने से यह पता चलता है कि इस विलयन से विद्युत का प्रवाह हो रहा है। अम्लीय विलयन में विद्युत धारा का प्रवाह अम्ल में उपस्थित इन्हीं आयनों द्वारा होता है।
अम्लों में धनायन H’ तथा ऋणायन जैसे HCI में CP, HNo, में No, CH, COOH में 3 CH,COO, H,So, में SO होते हैं। चूँकि अम्ल में उपस्थित धनायन H’ है, इससे ज्ञात होता है कि अम्ल विलयन में हाइड्रोजन आयन H’ (aq) उत्पन्न करता है, तथा इसी कारण उनका गुणधर्म अम्लीय होता है।
सोडियम हाइड्रॉक्साइड, कैल्सियम हाइड्रॉक्साइड आदि जैसे क्षारकों का उपयोग करके इस क्रियाकलाप को दोहराइए। इस क्रियाकलाप के परिणामों से आप क्या निष्कर्ष निकाल सकते हैं?
2.2.1 जलीय विलयन में अम्ल या क्षारक का क्या होता है?
क्या अम्ल केवल जलीय विलयन में ही आयन उत्पन्न करते हैं? आइए इसकी जाँच करें।
क्रियाकलाप 2.9
• एक स्वच्छ एवं शुष्क परखनली में लगभग 1 g ठोस NaCl लीजिए तथा चित्र 2.4 के अनुसार उपकरण व्यवस्थित कीजिए।
• परखनली में कुछ मात्रा में सांद्र सल्फ्यूरिक अम्ल डालिए।
• आपने क्या प्रेक्षण किया? क्या निकास नली से कोई गैस बाहर आ रही है?
• इस प्रकार उत्सर्जित गैस की सूखे तथा नम नीले लिटमस पत्र द्वारा जाँच कीजिए।
• किस स्थिति में लिटमस पत्र का रंग परिवर्तित होता है?
• उपरोक्त क्रियाकलाप के आधार पर आप निम्न के अम्लीय गुण के बारे में क्या निष्कर्ष निकाल सकते हैं:
(i) शुष्क HCI गैस
(ii) HCI विलयन ?
अध्यापकों के लिए निर्देश- यदि जलवायु अत्यधिक आई हो तो गैस को शुष्क करने के लिए आपको कैल्सियम क्लोराइड वाली शुष्क नली से गैस प्रवाहित करना होगा।
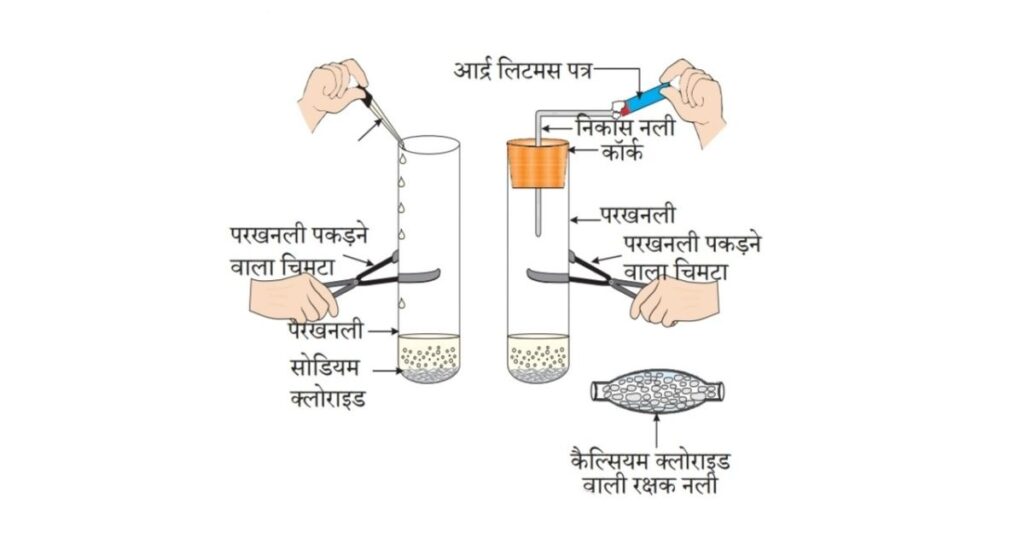
चित्र 2.4 HCl गैस का निर्माण
इस प्रयोग से यह स्पष्ट होता है कि जल की उपस्थिति में HCI में हाइड्रोजन आयन उत्पन्न होते हैं। जल की अनुपस्थिति में HCI अणुओं से H+आयन पृथक नहीं हो सकते हैं।
HCI + H2O → H3O+ + Cl–
हाइड्रोजन आयन स्वतंत्र रूप में नहीं रह सकते, लेकिन ये जल के अणुओं के साथ मिलकर रह सकते हैं। इसलिए हाइड्रोजन आयन को सदैव H’ (aq) या हाइड्रोनियम आयन (HO) से दर्शाना चाहिए।
H++ H2O → H3O+
हमने देखा कि अम्ल जल में H3O+ अथवा H+(aq) आयन प्रदान करता है। आइए, देखें कि 3 किसी क्षारक को जल में घोलने पर क्या होता है-
NaOH(s) → Na+(aq) + OH–(aq)
KOH(s) → K+(aq) + OH–(aq)
Mg(OH)2 (s) → Mg2+(aq) + 2OH– (aq)
क्षारक जल में हाइड्रॉक्साइड (OH–) आयन उत्पन्न करते हैं। जल में घुलनशील क्षारक को क्षार कहते हैं।
अब तक हम जान चुके हैं कि सभी अम्ल H’ (aq) तथा सभी क्षारक OH (aq) उत्पन्न करते हैं, अतः अब हम उदासीनीकरण अभिक्रिया को निम्नलिखित रूप में व्यक्त कर सकते हैं।
अम्ल + क्षारक लवण – जल
H X +M OH→ MX + HOH
H+(aq) + OH– (aq) → H2O(1)
आइए, देखें कि अम्ल या क्षारक में जल मिलाने पर क्या होता है
क्रियाकलाप 2.10
• एक बीकर में 10 mL जल लीजिए।
• इसमें कुछ बूँदें सांद्र सल्फ्यूरिक अम्ल (H₂SO₄) की डालकर बीकर धीरे-धीरे घुमाइए।
• बीकर के आधार को स्पर्श कीजिए।
• क्या तापमान में कोई परिवर्तन आया?
• यह प्रक्रिया क्या उष्माक्षेपी अथवा ऊष्माशोषी है?
• उपर्युक्त क्रियाकलाप को सोडियम हाइड्रॉक्साइड के साथ दोहराइए एवं अपने प्रेक्षण को लिखिए।
चित्र 2.5 सांद्र अम्ल तथा क्षारक वाले बर्तनों में लगे चेतावनी के चिह्न
जल में अम्ल या क्षारक के घुलने की प्रक्रिया अत्यंत ऊष्माक्षेपी होती है। जल में सांद्र नाइट्रिक अम्ल या सल्फ्यूरिक अम्ल को मिलाते समय अत्यंत सावधानी रखनी चाहिए। अम्ल को सदैव धीरे-धीरे तथा जल को लगातार हिलाते हुए जल में मिलाना चाहिए। सांद्र अम्ल में जल मिलाने पर उत्पन्न हुई ऊष्मा के कारण मिश्रण आस्फलित होकर बाहर आ सकता है तथा आप जल सकते हैं। साथ ही अत्यधिक स्थानीय ताप के कारण प्रयोग में उपयोग किया जा रहा काँच का पात्र भी टूट सकता है। सांद्र सल्फ्यूरिक अम्ल के कैन (डिब्बा) तथा सोडियम हाइड्रॉक्साइड की बोतल पर चेतावनी के चिह्न (चित्र 2.5 में प्रदर्शित) पर ध्यान दीजिए।
जल में अम्ल या क्षारक मिलाने पर आयन की सांद्रता (H3O+/OH–) में प्रति इकाई आयतन में कमी हो जाती है। इस प्रक्रिया को तनुकरण कहते हैं एवं अम्ल या क्षारक तनुकृत होते हैं।
2.3 अम्ल एवं क्षारक के विलयन कितने प्रबल होते हैं?
हम जानते हैं कि अम्ल-क्षारक के सूचकों का उपयोग करके अम्ल एवं क्षारक में अंतर प्रदर्शित किया जा सकता है। पिछले अध्याय में हमने H+ अथवा OH– आयनों के विलयों की सांद्रता कम होना तथा तनुकरण के बारे में पढ़ा था। क्या हम किसी विलयन में उपस्थित आयनों की संख्या जान सकते हैं? क्या हम ज्ञात कर सकते हैं कि विलयन में अम्ल अथवा क्षारक कितना प्रबल है?
इसको जानने के लिए हम सार्वत्रिक सूचक जो अनेक सूचकों का मिश्रण होता है, का उपयोग करके ज्ञात कर सकते हैं। सार्वत्रिक सूचक, किसी विलयन में हाइड्रोजन आयन की विभिन्न सांद्रता को विभिन्न रंगों में प्रदर्शित करते हैं।
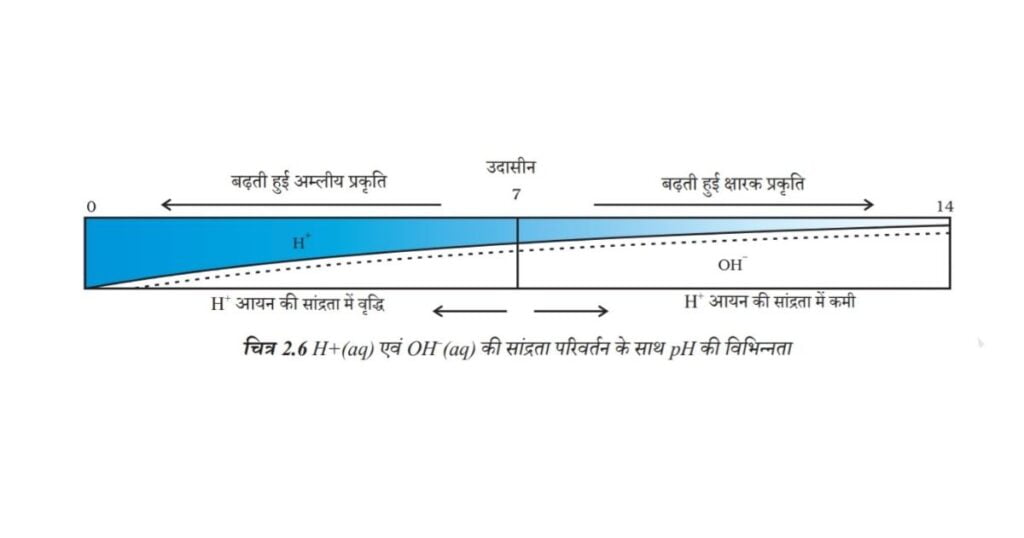
किसी विलयन में उपस्थित हाइड्रोजन आयन की सांद्रता ज्ञात करने के लिए एक स्केल विकसित किया गया, जिसे pH स्केल कहते हैं। इस pH में p सूचक है, ‘पुसांस’ (Potenz) जो एक जर्मन शब्द है, का अर्थ होता है ‘शक्ति’। इस pH स्केल से सामान्यतः शून्य (अधिक अम्लता) से चौदह (अधिक क्षारीय) तक pH को ज्ञात कर सकते हैं। साधारण भाषा pH को एक ऐसी संख्या के रूप में देखना चाहिए, जो किसी विलयन की अम्लता अथवा क्षारकीयता को दर्शाते हैं। हाइड्रोनियम आयन की सांद्रता जितनी अधिक होगी उसका pH उतना ही कम होगा।
किसी भी उदासीन विलयन के pH का मान 7 होगा। यदि pH स्केल में किसी विलयन का मान 7 से कम है तो यह अम्लीय विलयन होगा एवं यदि pH मान 7 से 14 तक बढ़ता है तो वह विलयन में OH– की सांद्रता में वृद्धि को दर्शाता है, अर्थात यहाँ क्षार की शक्ति (चित्र 2.6) बढ़ रही है। सामान्यतः pH सार्वत्रिक सूचक अंतर्भारित पेपर द्वारा ज्ञात किया जाता है।
क्रियाकलाप 2.11
दी गई सारणी 2.2 में विलयन के pH मानों की जाँच कीजिए।
• अपने प्रेक्षणों को लिखिए।
• आपके प्रेक्षणों के आधार पर प्रत्येक
• पदार्थ की प्रकृति क्या है?
| क्रम संख्या | विलयन | pH पत्र का रंग | लगभग pH मान | पदार्थ की प्रकृति |
| 1 | लार (खाना खाने के पहले) | |||
| 2 | लार (खाना खाने के बाद) | |||
| 3 | नींबू का रस | |||
| 4 | रंगरहित वातित पेय | |||
| 5 | गाजर का रस | |||
| 6 | कॉफी | |||
| 7 | टमाटर का रस | |||
| 8 | नल का जल | |||
| 9 | 1M NaOH | |||
| 10 | 1M HCl |
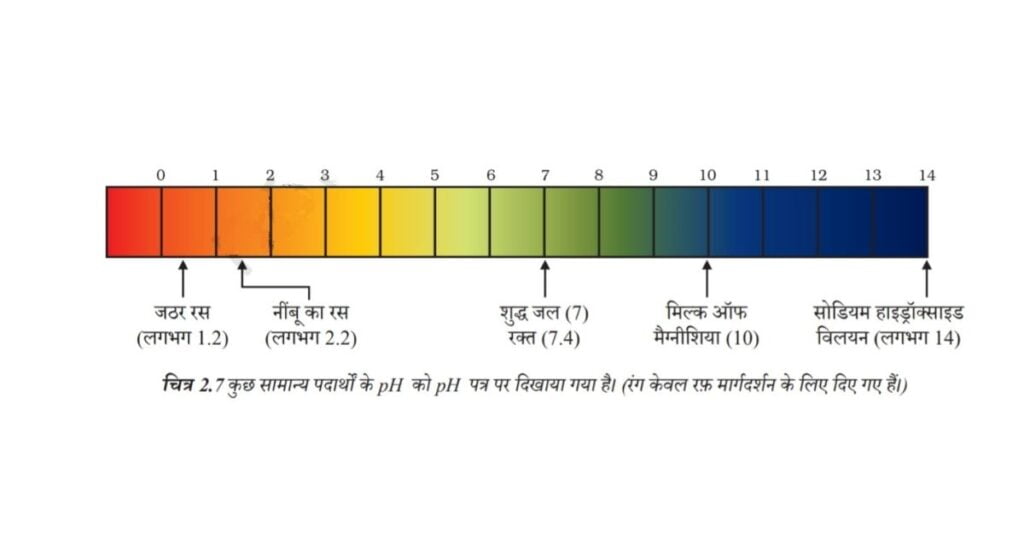
अम्ल तथा क्षारक की शक्ति विलयन (जल) में क्रमशः H+आयन तथा OH– आयन की संख्या पर निर्भर करती है। यदि हम समान सांद्रता के हाइड्रोक्लोरिक अम्ल तथा ऐसीटिक अम्ल, जैसे एक मोलर, विलयन लेते हैं तो वह विभिन्न मात्रा में हाइड्रोजन आयन उत्पन्न करेंगे। अधिक संख्या में H+ आयन उत्पन्न करने वाले अम्ल प्रबल अम्ल कहलाते हैं, जबकि कम H+ आयन उत्पन्न करने वाले अम्ल दुर्बल अम्ल कहलाएँगे। क्या आप अब यह बता सकते हैं कि दुर्बल एवं प्रबल क्षारक क्या होते हैं?
2.3.1 दैनिक जीवन में pH का महत्त्व
क्या पौधे एवं पशु pH के प्रति संवेदनशील होते हैं?
हमारा शरीर 7.0 से 7.8 pH परास के बीच कार्य करता है। जीवित प्राणी केवल संकीर्ण pH परास (परिसर) में ही जीवित रह सकते हैं। वर्षा के जल का pH मान जब 5.6 से कम हो जाता है तो वह अम्लीय वर्षा कहलाती है। अम्लीय वर्षा का जल जब नदी में प्रवाहित होता है तो नदी के जल के pH का मान कम हो जाता है। ऐसी नदी में जलीय जीवधारियों की उत्तरजीविता कठिन हो जाती है।
आपके बागीचे की मिट्टी का pH क्या है?
अच्छी उपज के लिए पौधों को एक विशिष्ट pH परास की आवश्यकता होती है। किसी पौधे के स्वस्थ विकास के लिए आवश्यक pH को ज्ञात करने के लिए विभिन्न स्थानों से मिट्टी एकत्र कीजिए एवं क्रियाकलाप 2.12 के अनुसार उनके pH की जाँच कीजिए। इस बात पर भी ध्यान दीजिए कि जहाँ से मिट्टी ले रहे हैं वहाँ कौन से पौधे उपज रहे हैं?
क्रियाकलाप 2.12
• एक परखनली में लगभग 2g मिट्टी रखिए एवं उसमें 5 mL जल मिलाइए।
• परखनली की सामग्री को हिलाइए।
• सामग्रियों को छानिए एवं परखनली में निस्यंद एकत्र कीजिए।
• सार्वत्रिक सूचक पत्र की सहायता से इस निस्यंद के pH की जाँच कीजिए।
• अपने क्षेत्र में पौधों के उपयुक्त विकास के लिए आदर्श मिट्टी के pH के संबंध में आपने क्या निष्कर्ष निकाला?
हमारे पाचन तंत्र का pH
यह अत्यन्त रोचक है कि हमारा उदर हाइड्रोक्लोरिक अम्ल (Hydrochloric acid) उत्पन्न करता है। यह उदर को हानि पहुँचाए बिना भोजन के पाचन में सहायक होता है। अपच की स्थिति में उदर अत्यधिक मात्रा में अम्ल उत्पन्न करता है, जिसके कारण उदर में दर्द एवं जलन का अनुभव होता है। इस दर्द से मुक्त होने के लिए ऐन्टैसिड (antacid) जैसे क्षारकों का उपयोग किया जाता है। इस अध्याय के आरंभ में ऐसा ही एक उपचार आपने अवश्य सुझाया होगा। यह ऐन्टैसिड अम्ल की आधिक्य मात्रा को उदासीन करता है। इसके लिए मैग्नीशियम हाइड्रॉक्साइड (मिल्क ऑफ मैगनीशिया) जैसे दुर्बल क्षारक का उपयोग किया जाता है।
pH परिवर्तन के कारण दंत-क्षय
मुँह के pH का मान 5.5 से कम होने पर दाँतों का क्षय प्रारंभ हो जाता है। दाँतों का इनैमल (दत्तवल्क) कैल्सियम हाइड्रोक्सीएपेटाइट (कैल्सियम फॉस्फेट का क्रिस्टलीय रूप) से बना होता है, जो कि शरीर का सबसे कठोर पदार्थ है। यह जल में नहीं घुलता, लेकिन मुँह के pH का मान 5.5 से कम होने पर यह संक्षारित हो जाता है। मुँह में उपस्थित बैक्टीरिया, भोजन के पश्चात मुँह में अवशिष्ट शर्करा एवं खाद्य पदार्थों का निम्नीकरण करके अम्ल उत्पन्न करते हैं। भोजन के बाद मुँह साफ़ करने से इससे बचाव किया जा सकता है। मुँह की सफ़ाई के लिए क्षारकीय दंत-मंजन का उपयोग करने से अम्ल की आधिक्य मात्रा को उदासीन किया जा सकता है, जिसके परिणामस्वरूप दंत क्षय को रोका जा सकता है।
पशुओं एवं पौधों द्वारा उत्पन्न रसायनों से आत्त्मरक्षा
क्या कभी आपको मधुमक्खी ने डंक मारा है? मधुमक्खी का डंक एक अम्ल छोड़ता है, जिसके कारण दर्द एवं जलन का अनुभव होता है। डंक मारे गए अंग में बेकिंग सोडा जैसे दुर्बल क्षारक के उपयोग से आराम मिलता है। नेटल (nettle) के डंक वाले बाल मेथेनॉइक अम्ल छोड़ जाते हैं, जिनके कारण जलन वाले दर्द का अनुभव होता है।
प्रकृति उदासीनीकरण के बिकल्प देती है
नेटल एक शाकीय पादप है, जो जंगलों में उपजता है। इसके पत्तों में डंकनुमा बाल होते हैं जो अगर गलती से छू जाएँ तो डंक जैसा दर्द होता है। इन बालों से मेथेनॉइक अम्ल का साव होने के कारण यह दर्द होता है। पारंपरिक तौर पर इसका इलाज डंक वाले स्थान पर डॉक पौधे की पत्ती रगड़कर किया जाता है। ये पौधे अधिकतर नेटल के पास ही पैदा होते हैं। क्या आप डॉक पौधे की प्रकृति का अनुमान लगा सकते हैं? आप अब जान गए हंगि कि अगली बार पहाड़ों पर चढ़ते हुए गलती से नेटल पौधे के छू जाने पर आपको क्या करना होगा? क्या आप ऐसे ही पारंपरिक इलाज जानते हैं, जो डंक लगने पर प्रभावी हों?
सारणी 2.3 कुछ प्राकृतिक अम्ल
| प्राकृतिक स्रोत | अम्ल | प्राकृतिक स्रोत | अम्ल |
| सिरका | ऐसीटिक अम्ल | खट्ट्टा दूध (दही) | लैक्टिक अम्ल |
| संतरा | सिट्रिक अम्ल | नींबू | सिट्रिक अम्ल |
| इमली | टार्टरिक अम्ल | चींटी का डंक | मेथेनॉइक अम्ल |
| टमाटर | ऑक्सेलिक अम्ल | नेटल का डंक | मेथेनॉइक अम्ल |
2.4 लवण के संबंध में अधिक जानकारी
पिछले भागों में हमने विभिन्न अभिक्रियाओं के द्वारा लवणों का निर्माण होते देखा है। आइए, इनके निर्माण, गुणधर्म एवं उपयोग के बारे में अधिक जानकारी प्राप्त करें।
2.4.1 लवण परिवार
क्रियाकलाप 2.13
• नीचे दिए गए लवण के रासायनिक सूत्र लिखिए
• पोटैशियम सल्फेट, सोडियम सल्फेट, कैल्सियम सल्फेट, मैग्नीशियम सल्फेट, कॉपर सल्फेट, सोडियम क्लोराइड, सोडियम नाइट्रेट, सोडियम कार्बोनेट एवं अमोनियम क्लोराइड।
• उन अम्ल एवं क्षारक की पहचान कीजिए, जिससे उपरोक्त लवण प्राप्त किए जा सकते हैं।
• समान धन या ऋण मूलक वाले लवणों को एक ही परिवार का कहा जाता है, जैसे- NaCl एवं Na2SO4 सोडियम लवण के परिवार का है। इसी प्रकार NaCl एवं KCI क्लोराइड लवण के परिवार के हैं। इस क्रियाकलाप में दिए गए लवणों में आप कितने परिवारों की पहचान कर सकते हैं?
2.4.2 लवणों का pH
क्रियाकलाप 2.14
• निम्नलिखित लवों के नमूने एकत्र कीजिए-
• सोडियम क्लोराइड, पोटेशियम नाइट्रेट, एल्युमिनियम क्लोराइड, जिंक सल्फेट, कॉपर सल्फेट, सोडियम ऐसीटेट, सोडियम कार्बनिट एवं सोडियम हाइड्रोजनकार्बोनेट (कुछ अन्य लवण जो उपलब्ध हो।)
• जल में इनकी विलेयता की जाँच कीजिए। (केवल आसवित जल का उपयोग कीजिए।)
• लिटमस पर इन विलयनों की क्रिया की जाँच कीजिए एवं pH पेपर का उपयोग कर इनके PH के मान का पता लगाइए।
• कौन से लवण अम्लीय, क्षारकीय या उदासीन है?
• लवण बनाने के लिए उपयोग होने वाले अम्ल या क्षारक की पहचान कीजिए।
• अपने प्रेक्षणों को सारणी 2.4 में लिखिए।
सारणी 2.4
| नमक | pH | प्रयुक्त अम्ल | प्रयुक्त क्षारक |
प्रबल अम्ल एवं प्रबल क्षारक के लवण के pH का मान 7 होता है तथा ये उदासीन होते हैं, जबकि प्रबल अम्ल एवं दुर्बल क्षारक के लवण के pH का मान 7 से कम होता है तथा ये अम्लीय होते हैं। प्रबल क्षारक एवं दुर्बल अम्ल के लवण के pH का मान 7 से अधिक होता है तथा ये क्षारकीय होते हैं।
2.4.3 साधारण नमक से रसायन
आप जानते हैं कि हाइड्रोक्लोरिक अम्ल एवं सोडियम हाइड्रॉक्साइड के विलयन की अभिक्रिया से उत्पन्न लवण को सोडियम क्लोराइड कहते हैं। इसी लवण का हम अपने भोजन में उपयोग करते हैं। ऊपर के क्रियाकलाप में आपने देखा होगा कि यह एक उदासीन लवण है।
समुद्री जल में कई प्रकार के लवण घुले होते हैं। इन लवणों से सोडियम क्लोराइड को पृथक किया जाता है। विश्व के कई भागों में भी ठोस लवण का निक्षेप होता है। बड़े आकार के यह क्रिस्टल प्रायः अपद्रव्यों के कारण भूरे रंग के हाते हैं। इसे खनिज नमक कहते हैं। यह खनिज नमक तब बने जब युगों के व्यतीत होने के साथ समुद्र का कोई हिस्सा सूख गया। खनिज नमक का खनन भी कोयले की तरह हाता है।
आपने महात्मा गांधी के दांडी यात्रा के बारे में अवश्य सुना होगा। क्या आप जानते हैं कि हमारे स्वतंत्रता संग्राम में नमक एक महत्वपूर्ण प्रतीक था?
साधारण नमक- रसायनों का कच्चा पदार्थ
इस प्रकार प्राप्त साधारण नमक हमारे दैनिक उपयोग के कई पदार्थों; जैसे-सोडियम हाइड्रॉक्साइड, बेकिंग सोडा, वाशिंग सोडा, विरंजक चूर्ण आदि के लिए एक महत्वपूर्ण कच्चा पदार्थ है। आइए, देखते हैं कि कैसे एक पदार्थ का उपयोग विभिन्न पदार्थ बनाने के लिए करते हैं।
सोडियम हाइड्रॉक्साइड
सोडियम क्लोराइड के जलीय विलयन (लवण जल) से विद्युत प्रवाहित करने पर यह वियोजित होकर सोडियम हाइड्रॉक्साइड उत्पन्न करता है। इस प्रक्रिया को क्लोर-क्षार प्रक्रिया कहते हैं, क्योंकि इससे निर्मित उत्पाद क्लोरीन (क्लोर) एवं सोडियम हाइड्रॉक्साइड (क्षार) होते हैं।
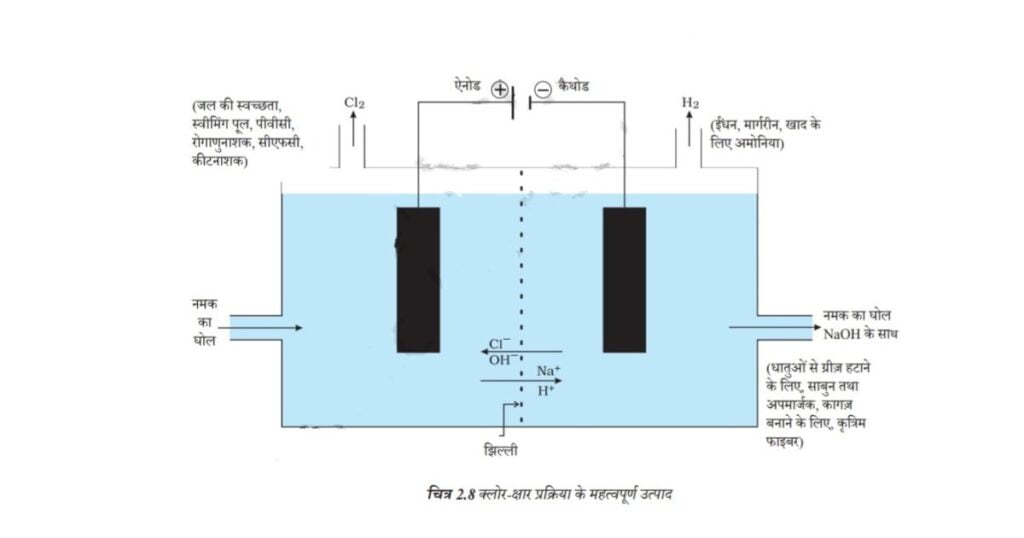
2NaCl(aq) + 2H2O(1) → 2NaOH(aq) + Cl2(g) + H2(g)
क्लोरीन गैस ऐनोड पर एवं हाइड्रोजन गैस कैथोड पर मुक्त होती है। कैथोड पर सोडियम हाइड्रॉक्साइड विलयन का निर्माण भी होता है। इस प्रक्रिया से उत्पन्न हुए तीनों उत्पाद उपयोगी हैं। चित्र 2.8 इन उत्पादों के विभिन्न उपयोगों को दर्शाता है।
विरंजक चूर्ण
आप जानते हैं कि जलीय सोडियम क्लोराइड (लवण जल) के विद्युत अपघटन से क्लोरीन का निर्माण होता है। इस क्लोरीन गैस का उपयोग विरंजक चूर्ण के उत्पादन के लिए किया जाता है। शुष्क बुझा हुआ चूना [Ca(OH)2] पर क्लोरीन की क्रिया से विरंजक चूर्ण का निर्माण होता है। विरंजक चूर्ण को CaOCl2 से दर्शाया जाता है, यद्यपि वास्तविक संगठन काफ़ी जटिल होता है।
Ca(OH)2 + Cl2 → CaOCl2 + H2O
विरंचक चूर्ण का उपयोग-
(i) वस्त्र उद्योग में सूती एवं लिनेन के विरंजन के लिए कागज़ की फैक्ट्री में लकड़ी की मज्जा एवं लाउंड्री में साफ़ कपड़ों के विरंजन के लिए,
(ii) कई रासायनिक उद्योगों में एक उपचायक के रूप में एवं,
(iii) पीने वाले जल को जीवाणुओं से मुक्त करने के लिए।
बेकिंग सोडा
बेकिंग सोडा का उपयोग आमतौर पर रसोईघर में स्वादिष्ट खस्ता पकौड़े आदि बनाने के लिए किया जाता है। कभी-कभी इसका उपयोग खाने को शीघ्रता से पकाने के लिए भी किया जाता है। इस यौगिक का रासायनिक नाम सोडियम हाइड्रोजनकार्बोनेट (NaHCO₃) है। इसको बनाने में सोडियम क्लोराइड का उपयोग एक मूल पदार्थ के रूप में किया जाता है।
NaCL + H₂O + CO₂ + NH3 → NH4Cl + NaHCO3
क्रियाकलाप 2.14 में क्या आपने सोडियम हाइड्रोजनकार्बनिट के pH के मान की जाँच की थी? क्या आप सह संबंध स्थापित कर सकते हैं कि- क्यों इसका उपयोग एक अम्ल को उदासीन करने में किया जाता है? यह एक दुर्बल असंक्षारक क्षारीय लवण है। खाना पकाते समय इसे गर्म करने पर निम्न अभिक्रिया होती है-
2NaHCO3 (सोडियम हाइड्रोजनकार्बोनेट) → Na2CO3 + H2O+CO2 (सोडियम कार्बनिट)
सोडियम हाइड्रोजनकार्बोनेट का उपयोग हमारे घरों में अनेक प्रकार से किया जाता है।
बेकिंग सोडा का उपयोग
(i) बेकिंग पाउडर बनाने में, जो बेकिंग सोडा (सोडियम हाइड्रोजनकार्बोनेट) एवं टार्टरिक अम्ल जैसा एक मंद खाद्य अम्ल का मिश्रण है। जब बेकिंग पाउडर को गर्म किया जाता है या जल में मिलाया जाता है तो निम्न अभिक्रिया होती है-
NaHCO3 + H+ → CO2 + H2O + अम्ल का सोडियम लवण
इस अभिक्रिया से उत्पन्न कार्बन डाइऑक्साइड के द्वारा पावरोटी या केक में खमीर उठाया जा सकता है तथा इससे ये मुलायम एवं स्पंजी हो जाता है।
(ii) सोडियम हाइड्रोजनकार्बोनेट भी ऐन्टैसिड का एक संघटक है। क्षारीय होने के कारण यह पेट में अम्ल की अधिकता को उदासीन करके राहत पहुँचाता है।
(iii) इसका उपयोग सोडा-अम्ल अग्निशामक में भी किया जाता है।
धोने का सोडा
Na2CO3.10H2O (धोने का सोडा) एक अन्य रसायन, जिसे सोडियम क्लोराइड से प्राप्त किया जा सकता है। आप ऊपर देख चुके हैं कि बेकिंग सोडा को गर्म करके सोडियम कार्बोनेट प्राप्त किया जा सकता है। सोडियम कार्बोनेट के पुनः क्रिस्टलीकरण से धोने का सोडा प्राप्त होता है। यह भी एक क्षारकीय लवण है।
Na2CO3 (सोडियम कार्बनिट) + 10H2O → Na2CO3.10H2O
10H2O क्या दर्शाता है? क्या यह Na2CO3 को आर्द्र बनाता है? हम इसका उत्तर अगले 2 भाग में पढ़ेंगे।
सोडियम कार्बोनेट एवं सोडियम हाइड्रोजनकार्बोनेट, कई औद्योगिक प्रक्रियाओं के लिए भी उपयोगी रसायन है।
धोने के सोडे के उपयोग
(i) सोडियम कार्बोनेट का उपयोग काँच, साबुन एवं कागज़ उद्योगों में होता है।
(ii) इसका उपयोग बोरेक्स जैसे सोडियम योगिक के उत्पादन में होता है।
(iii) सोडियम कार्बोनेट का उपयोग घरों में साफ़-सफ़ाई के लिए होता है।
(iv) जल की स्थायी कठोरता को हटाने के लिए इसका उपयोग होता है।
2.4.4 क्या लवण के क्रिस्टल वास्तव में शुष्क हैं?
क्रियाकलाप 2.15
• कॉपर सल्फेट के कुछ क्रिस्टल को शुष्क क्वथन नली में गर्म कीजिए।
• गर्म करने के बाद कॉपर सल्फेट का रंग क्या है?
• क्वथन नली में क्या जल की बूँदें नज़र आती हैं? ये कहाँ से आई?
• गर्म करने के बाद प्राप्त कॉपर सल्फेट के नमूने में जल की 2-3 बूँदें डालिए।
• आप क्या प्रेक्षण करते हैं? क्या कॉपर सल्फेट का नीला रंग वापस आ जाता है?
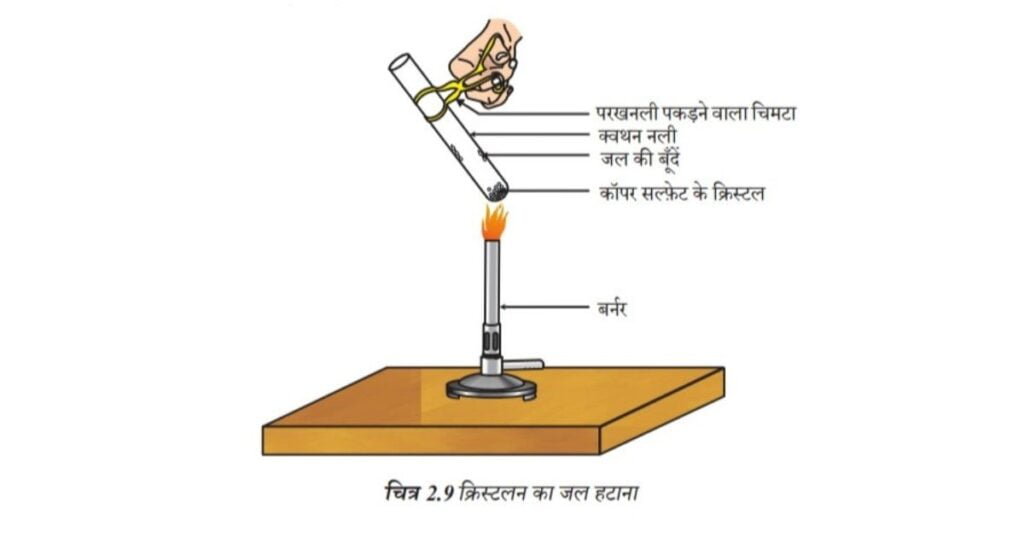
चित्र 2.9 क्रिस्टलन का जल हटाना
शुष्क दिखने वाले कॉपर सल्फेट क्रिस्टलों में क्रिस्टलन का जल होता है। जब हम क्रिस्टल को गर्म करते हैं तो यह जल हट जाता है एवं लवण का रंग श्वेत हो जाता है।
यदि आप क्रिस्टल को पुनः जल से भिगोते हैं तो क्रिस्टल का नीला रंग वापस आ जाता है।
लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं। कॉपर सल्फेट की एक सूत्र इकाई में जल के पाँच अणु उपस्थित होते हैं। जलीय कॉपर सल्फेट का रासायनिक सूत्र CuSO4 .5H2O है। क्या आप अब बता सकते हैं कि Na2CO3.10H2O का अणु आई है या नहीं।
जिप्सम एक अन्य लवण है, जिसमें क्रिस्टलन का जल होता है। इसमें क्रिस्टलन के जल के दो अणु होते हैं। इसका रासायनिक सूत्र CaSO4 . 2H2O है। अब हम इस लवण के उपयोगों पर ध्यान देते हैं।
प्लास्टर ऑफ पेरिस
जिप्सम को 373 K पर गर्म करने पर यह जल के अणुओं का त्याग कर कैल्सियम सल्फेट अर्धहाइड्रेट या हेमिहाइड्रेट (CaSO4 .1/2 H2O) बनाता है। इसे प्लास्टर ऑफ पेरिस कहते हैं। इस पदार्थ का उपयोग डॉक्टर टूटी हुई हड्डियों को सही जगह पर स्थिर रखने के लिए करते हैं। प्लास्टर ऑफ पेरिस एक सफ़ेद चूर्ण है, जो जल मिलाने पर यह पुनः जिप्सम बनकर कठोर ठोस पदार्थ प्रदान करता है।
CaSO4 .1/2 H2O + (1) 1/2 H2O→ CaSO4 . 2H2O
ध्यान दीजिए कि जल का केवल आधा अणु क्रिस्टलन के जल के रूप में जुड़ा होता है। जल का आधा अणु कैसे प्राप्त होता है? CaSO4 का दो इकाई सूत्र जल के एक अणु के साथ साझेदारी करते हैं। प्लास्टर ऑफ पेरिस का उपयोग खिलौना बनाने, सजावट का सामान एवं सतह को चिकना बनाने के लिए किया जाता है। पता करें कि कैल्सियम सल्फेट अर्धहाइड्रेट को प्लास्टर ऑफ पेरिस क्यों कहा जाता है?
आपने क्या सीखा
• अम्ल-क्षारक सूचक रंजक या रंजकों के मिश्रण होते हैं, जिनका उपयोग अम्ल एवं क्षारक की उपस्थिति को सूचित करने के लिए किया जाता है।
• विलयन में H+(aq) आयन के निर्माण के कारण ही पदार्थ की प्रकृति अम्लीय होती है। विलयन में OH–(aq) आयन के निर्माण से पदार्थ की प्रकृति क्षारकीय होती है।
• जब कोई अम्ल किसी धातु के साथ अभिक्रिया करता है तो हाइड्रोजन गैस का उत्सर्जन होता है। साथ ही संगत लवण का निर्माण होता है।
• जब क्षारक किसी धातु से अभिक्रिया करता है तो हाइड्रोजन गैस के उत्सर्जन के साथ एक लवण का निर्माण होता है जिसका ऋण आयन एक धातु एवं ऑक्सीजन के परमाणुओं से संयुक्त रूप से निर्मित होता है।
• जब अम्ल किसी धातु कार्बोनेट या धातु हाइड्रोजनकार्बनिट से अभिक्रिया करता है तो यह संगत लवण कार्बन डाइऑक्साइड गैस एवं जल उत्पन्न करता है।
• जल में अम्लीय एवं क्षारकीय विलयन विद्युत का चालन करते हैं, क्योंकि ये क्रमशः हाइड्रोजन एवं हाइड्रॉक्साइड आयन का निर्माण करते हैं।
• अम्ल या क्षारक की प्रबलता की जाँच pH (0-14) स्केल के उपयोग से की जा सकती है, जो विलयन में हाइड्रोजन आवन की सांद्रता की माप होता है।
• एक उदासीन विलयन के pH का मान 7 होता है, जबकि अम्लीय विलयन के pH का मान 7 से कम एवं क्षारकीय विलयन के pH का मान 7 से अधिक होता है।
• सभी जीवों में उपापचय की क्रिया pH की एक इष्टतम सीमा में होती है।
• सांद्र अम्ल या क्षारक को जल के साथ मिश्रित करना एक अत्यन्त ऊष्माक्षेपी अभिक्रिया है।
• अम्ल एवं क्षारक एक-दूसरे को उदासीन करके लवण एवं जल का निर्माण करते हैं।
• लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं।
• हमारे दैनिक जीवन एवं उद्योगों में लवण के कई उपयोग हैं।
यह भी पढ़ें : रासायनिक अभिक्रियाएँ एवं समीकरण : अध्याय 1
प्रश्न अभ्यास
1. कोई विलयन लाल लिटमस को नीला कर देता है, इसका pH संभवतः क्या होगा?
(a) 1
(b) 4
(c) 5
(d) 10
Ans. (d) 10 (क्योंकि क्षारीय विलयन में लाल लिटमस नीला हो जाता है जिसका pH>7 होता है।)
2. कोई विलयन अंडे के पिसे हुए कवच से अभिक्रिया कर एक गैस उत्पन्न करता है, जो चूने के पानी को दूधिया कर देती है। इस विलयन में क्या होगा?
(a) NaCl
(b) HCI
(c) LiCl
(d) KCI
Ans. HCl ( क्योंकि अंडे के कवच में CaCO3 होता है, जो HCl अम्ल से अभिक्रिया कर CO2 गैस बनाता है। CO2 गैस चूने के पानी को दुधिया कर देती है।)
3. NaOH का 10 ml. विलयन, HCI के 8 mL. विलयन से पूर्णतः उदासीन हो बाता है। यदि हम NaOH के उसी विलयन का 20 mL लें तो इसे उदासीन करने के लिए HCI के उसी विलयन की कितनी मात्रा की आवश्यकता होगी?
(a) 4 mL
(b) 8 mL
(c) 12 mL
(d) 16 mL
Ans. (d) 16 mL
4. अपच का उपचार करने के लिए निम्नलिखित में से किस औषधि का उपयोग होता है?
(a) एंटीबायोटिक (प्रतिजैविक)
(b) ऐनालबेसिक (पीड़ाहरी)
(c) ऐन्टैसिड
(d) एंटीसेप्टिक (प्रतिरोधी)
Ans. (c) ऐन्टैसिड
5. निम्नलिखित अभिक्रिया के लिए पहले शब्द-समीकरण लिखिए तथा उसके बाद संतुलित समीकरण लिखिए-
(a) तनु सल्फ्यूरिक अम्ल दानेदार जिंक के साथ अभिक्रिया करता है।
Ans. H2SO4 (aq) + Zn (s) → ZnSO4 (aq) + H2 (g)
(b) तनु हाइड्रोक्लोरिक अम्ल मैग्नीशियम पट्टी के साथ अभिक्रिया करता है।
Ans. 2HCl (aq) + Mg (s) → MgCl2 + H2 (g)
(c) तनु सल्फ्यूरिक अम्ल एल्युमिनियम चूर्ण के साथ अभिक्रिया करता है।
Ans. 3H2SO4 (aq) + 2Al → Al2(SO4)3 (aq) + 3H2 (g)
(d) तनु हाइड्रोक्लोरिक अम्ल लौह के रेतन के साथ अभिक्रिया करता है।
Ans. 6HCl (aq) + 2Fe (s) → 2FeCl3 + 3H2 (g)
6. एल्कोहल एवं ग्लूकोज़ जैसे यौगिकों में भी हाइड्रोजन होते हैं, लेकिन इनका वर्गीकरण अम्ल की तरह नहीं होता है। एक क्रियाकलाप द्वारा इसे साबित कीजिए।
Ans.
विधि–
- ग्लूकोज, ऐल्कोहॉल तथा हाइड्रोक्लोरिक अम्ल का विलयन लीजिए।
- एक कॉर्क पर दो कीलें लगाकर कार्क को 100 ml के बीकर में रख दीजिए।
- चित्र 2.6 के अनुसार कीलों को 6 वोल्ट की एक बैट्री के दोनों टर्मिनलों के साथ एक बल्ब तथा स्विच के माध्यम से जोड़ दीजिए। अब बीकर में थोड़ा तनु HCl डालकर विद्युत धारा प्रवाहित कीजिए।
- अब स्विच ऑन कीजिए आप देखेंगे कि बल्ब जल उठता है।
- इस क्रियाकलाप को HCl के स्थान पर बारी-बारी से ग्लूकोज और ऐल्कोहॉल के विलयन के साथ करिए।
अवलोकन- आप पाएँगे कि ऐल्कोहॉल और ग्लूकोज़ की स्थिति में बल्ब नहीं जलता है, क्योंकि विलयनों में H+ आयन नहीं बनता है।
निष्कर्ष- ग्लूकोज़ और ऐल्कोहॉल H+ आयन नहीं उत्पन्न करते हैं। किसी विलयन में विद्युत धारा का प्रवाह आयनों द्वारा होता है। इसलिए इन्हें अम्ल नहीं कहा जाता है।
7. आसवित जल विद्युत का चालक क्या नहीं होता, जबकि वर्षा जल होता है?
Ans.
- आसवित जल शुद्ध होते हैं, जिसमें आयन नहीं बनता है तथा विद्युत चालन करता है। विद्युत का चालन आयनों द्वारा होता है।
- वर्षा के जल में थोड़ी मात्रा में अम्ल होते हैं, क्योंकि वायु में उपस्थित SO2और NO2 गैस जल में मिलकर इसे अम्लीय बना देते हैं। ये अम्ल (H+) आयन उत्पन्न करते हैं, जिसके कारण विद्युत धारा का चालन हो जाता है।
8. जल की अनुपस्थिति में अम्ल का व्यवहार अम्लीय क्यों नहीं होता है?
Ans. क्योंकि जल की अनुपस्थिति में अम्लों से H+ आयन पृथक नहीं हो पाते हैं, इसलिए अम्ल का व्यवहार अम्लीय नहीं होता है। केवल जल की उपस्थिति में ही H+ आयन अलग हो पाते हैं तथा अम्लीय अभिलक्षण दर्शाने के लिए आयनों का बनना जरूरी होता है।
9. पाँच विलयनों A, B, C, D, व E की जब सार्वत्रिक सूचक से जाँच की जाती है तो pH के मान क्रमशः 4, 1, 11, 7 एवं 9 प्राप्त होते हैं। कौन सा विलयन-
(a) उदासीन है?
(b) प्रबल क्षारीय है?
(c) प्रबल अम्लीय है?
(d) दुर्बल अम्लीय है?
(e) दुर्बल क्षारीय है?
pH के मानों को हाइड्रोजन आयन की सांद्रता के आरोही क्रम में व्यवस्थित कीजिए।
Ans.
| विलयन | pH का मान | सार्वत्रिक सूचक से जांच |
| A | 4 | दुर्बल अम्लीय है |
| B | 1 | प्रबल अम्लीय है |
| C | 11 | प्रबल क्षारीय है |
| D | 7 | उदासीन है |
| E | 9 | दुर्बल क्षारीय है |
H+ आयन की सांद्रता जैसे – जैसे बढती है pH का मान उसी प्रकार घटता है | C < E< D< A < B
10. परखनली ‘A’ एवं ‘B’ में समान लंबाई की मैग्नीशियम की पट्टी लीजिए। परखनली A’ में हाइड्रोक्लोरिक अम्ल (HCI) तथा परखनली ‘B’ में ऐसिटिक अम्ल (CH, COOH) डालिए। दोनों अम्लों की मात्रा तथा सांद्रता समान हैं। किस परखनली में अधिक तेजी से बुदबुदाहट होगी तथा क्यों?
Ans. परखनली A में बुदबुदाहट अधिक तेजी से होती है, क्योंकि HCl एक प्रबल अम्ल है, जो पूर्णतः वियोजित होकर H+ और Cl– आयन अधिक मात्रा में बनाते हैं जबकि CH3COOH एक दुर्बल अम्ल है, जो कम मात्रा में H’ आयन बनाते हैं क्योंकि यह कम विघटित हो पाता है।
11. ताजे दूध के pH का मान 6 होता है। दही बन जाने पर इसके pH के मान में क्या परिवर्तन होगा? अपना उत्तर समझाइए।
Ans. दूध से दही बनने की प्रक्रिया में लैक्टिक अम्ल का निर्माण होता है, जिसके कारण इसका pH: 6 से कम हो जाता है।
12. एक ग्वाला ताजे दूध में थोड़ा बेकिंग सोडा मिलाता है।
(a) ताजा दूध के pH के मान को 6 से बदलकर थोड़ा क्षारीय क्यों बना देता है?
Ans. ताज़ा दूध के pH के मान को 6 से बदलकर थोड़ा क्षारीय इसलिए किया जाता है, क्योंकि क्षारीय दूध अधिक समय तक खराब नहीं होता है।
(b) इस दूध को दही बनने में अधिक समय क्यों लगता है?
Ans. इस दूध को दही बनने में अधिक समय इसलिए लगता है, क्योंकि इस प्रक्रिया में बना लैक्टिक अम्ल पहले क्षारक को उदासीन करता है फिर अम्लीय होता है, जिसके कारण दही बनता है।
13. प्लास्टर ऑफ पेरिस को आई-रोधी बर्तन में क्यों रखा जाना चाहिए। इसकी व्याख्या कीजिए।
Ans. प्लास्टर ऑफ पेरिस को आर्द्र-रोधी (moisture-proof) बर्तनों में इसलिए रखा जाता है, क्योंकि यह आर्द्रता की उपस्थिति में जल को अवशोषित कर ठोस पदार्थ जिप्सम बनाती है, जिसके कारण इसमें जल के साथ मिलकर जमने का गुण नष्ट हो जाता है।
CaSO4 .1/2 H2O + (1) 1/2 H2O → CaSO4 . 2H2O
14. उदासीनीकरण अभिक्रिया क्या है? दो उदाहरण दीजिए।
Ans. जब कोई क्षार अम्ल से अभिक्रिया करता है तो लवण तथा जल बनता है। इस अभिक्रिया को उदासीनीकरण अभिक्रिया कहते हैं।
उदाहरण : सोडियम हाइड्रोऑक्सइड , हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया करके साधारण नमक तथा जल बनता है।
NaOH + HCl → NaCl + H2O
उदाहरण : मैग्निसियम हाइड्रोऑक्सइड , हाइड्रोक्लोरिक अम्ल के साथ अभिक्रिया करके मैग्निसियम क्लोराइड तथा जल बनता है।
Mg(OH)2 + 2HCl → MgCl2 + 2H2O
15. धोने का सोडा एवं बेकिंग सोडा के दो-दो प्रमुख उपयोग बताइए।
Ans.
1. धोने के सोडे का उपयोग-
- सोडियम कार्बोनेट (धोने का सोडा) का उपयोग काँच, साबुन एवं कागज उद्योगों में होता है।
- सोडियम कार्बोनेट का उपयोग घरों में साफ़-सफ़ाई के लिए होता है।
2. बेकिंग सोडा (NaHCO3) का उपयोग–
- बेकिंग पाउडर बनाने में जो बेकिंग सोडा और टार्टरिक अम्ल का मिश्रण है।
- इसका उपयोग सोडा-अम्ल अग्निशामक में भी किया जाता है।
